题目内容
【题目】(10分)写出下列反应的化学方程式,并判断所属的基本反应类型。
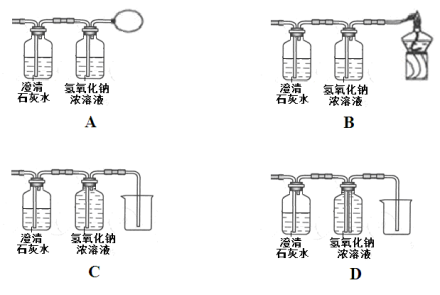
(1)硫燃烧 属于 反应;
(2)铁丝在氧气中燃烧
(3)水通电
(4)氯酸钾和二氧化锰混合加热制氧气 ,属于 反应
【答案】(1) 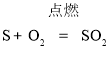 ;化合反应; (2)
;化合反应; (2) 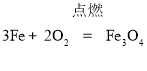 ;(3)
;(3) 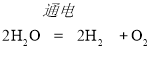 ;(4)
;(4) 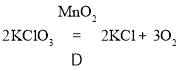 ;分解反应.
;分解反应.
【解析】(1)硫燃烧生成二氧化硫,反应的化学方程式为: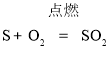 ;该反应符合“多变一”的特征,属于化合反应.
;该反应符合“多变一”的特征,属于化合反应.
(2)铁丝在氧气中燃烧生成四氧化三铁,反应的化学方程式为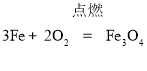 .
.
(3)过氧化氢在二氧化锰的催化作用下生成水和氧气,反应的化学方程式为: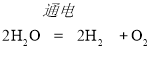 .
.
(4)氯酸钾在二氧化锰的催化作用下生成氯化钾和氧气,反应的化学方程式为: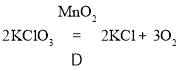 ,该反应的特点为“一变多”,属于分解反应.
,该反应的特点为“一变多”,属于分解反应.
试题分析:根据书写方程式的原则:遵循质量守恒定律,遵守客观事实分析;根据化合反应属于“多变一”,分解反应属于“一变多”分析.
考点:化学方程式的书写方法;基本反应类型的特点

 名校课堂系列答案
名校课堂系列答案【题目】(17分)钢铁是重要的金属材料,在工农业生产和生活中应用非常广泛。
I.铁的冶炼
工业炼铁的原理是高温下用CO作还原剂,将铁从氧化物中还原出来。请回答下列问题:
(1)高炉炼铁中,焦炭的作用除了可以生成一氧化碳外,还能 ;
(2)某钢铁厂每天消耗5000t含氧化铁80%的赤铁矿石,该厂理论上可日产含铁98%的生铁的质量是多少?
II.实验探究炼铁原理某化学兴趣小组在实验室中模拟工业炼铁的原理,并探究CO与Fe2O3反应后的产物。通过查阅资料知道:①草酸(H2C2O4)固体与浓硫酸混合加热会产生一氧化碳,反应方程式为:H2C2O4 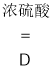 CO↑+ CO2↑+ H2O。
CO↑+ CO2↑+ H2O。
②NaOH溶液可以吸收二氧化碳,反应方程式为:2NaOH+CO2=Na2CO3+H2O
③常温下,Ca(OH)2微溶于水;于是他设计了下图的实验装置,结合装置回答下列问题:
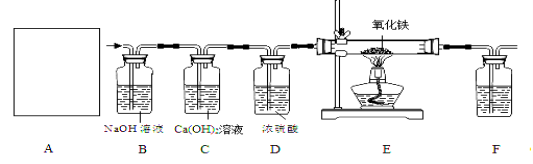
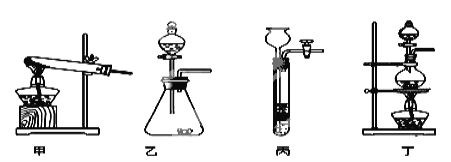
(1)图A是用固体草酸和浓硫酸制取CO的反应装置,你认为应选择下图中的 (填装置编号);
(2)图中装置C、D的作用分别是 、 ;
(3)为了证明产物中有二氧化碳,装置F中的试剂应该是少量的澄清石灰水,该反应的化学方程式为 ;
(4)该装置设计有一个明显缺陷,你认为是 。
(5)实验时准确称取一定质量纯净的Fe2O3固体按上图进行实验,当E中固体全部变黑后,继续通入CO直到玻璃管冷却。将得到黑色的固体加入到足量的稀盐酸,发现固体全部溶解,但无气泡产生。
查阅资料:a.铁的氧化物在足量的稀盐酸中均能全部溶解。
b.Fe2O3与CO反应的固体生成物可能情况如下:
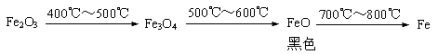
根据“无气泡”猜想,黑色粉末可能是:① Fe3O4 ;② ③ 。
(6)定量分析 用电子天平称量得部分数据如下:
玻璃管质 | 玻璃管及其中固体的质量 | 装置F及其中物质的总质量 | |
反应前 | 28.20 g | 33.00 g | 300.0 g |
反应后 | 32.84 g | 300.4 g |
根据上述数据,请选择有效的数据,推断出反应后黑色固体的成分。(写出计算过程)
【题目】(7分)某化学兴趣小组用下图装置完成木炭还原氧化铜的实验,并对生成的红色固体成分进行探究。
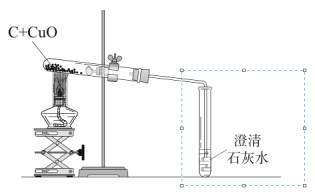
【提出问题】木炭与氧化铜反应生成的红色固体中含有什么物质?
【查阅资料】木炭与氧化铜反应也可能生成氧化亚铜(Cu2O);氧化亚铜是红色固体,能与稀硫酸反应:Cu2O+H2SO4![]() Cu+CuSO4+H2O。
Cu+CuSO4+H2O。
【进行猜想】木炭与氧化铜反应生成的红色固体成分:
①全部是铜; ②全部是 ; ③是两者的混合物。
【实验探究】
(1)用上图装置完成木炭还原氧化铜的实验,观察到澄清石灰水 。
(2)试管冷却后,观察到黑色固体全部变为红色,对生成的红色固体成分进行探究:
步 骤 | 现 象 | 结 论 |
①取1.8g红色固体于试管中, 滴加足量 ,充分反应 | 猜想①错误 | |
②过滤,将滤渣洗涤、干燥、称量 | 所得固体质量 | 猜想③正确 |
【反思与评价】木炭还原氧化铜的实验中,生成的气体可能含有一氧化碳,为了防止对空气造成污染,可将上图虚线方框内的装置改为 (选填字母)。