题目内容
 (1)氢氧化钠是一种常用的碱,其溶液显碱性,原因是该溶液中含有
(1)氢氧化钠是一种常用的碱,其溶液显碱性,原因是该溶液中含有OH-
OH-
离子(写离子符号),该溶液的pH>
>
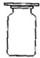
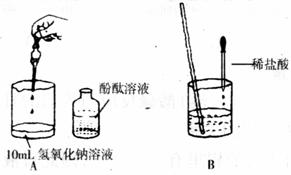
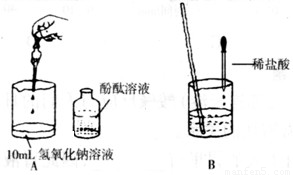
7(填“>,<或=”).(2)刘丽同学根据右图操作进行氢氧化钠溶液与稀盐酸发生酸碱中和反应的实验.当滴加酚酞后,溶液显
红
红
色.如果再滴加稀盐酸时,发现盐酸多滴加了,可选择碳酸钠(或锌粒(常用活泼金属))
碳酸钠(或锌粒(常用活泼金属))
(写一种试剂名称)来证明盐酸过量.(3)另两位同学也展开了探究:①小红取来一瓶氢氧化钠溶液,发现没有密封好,这将造成溶液吸收空气中的
CO2
CO2
而变质,据此你可以提出的一向合理建议是实验时用完试剂后随手盖上瓶塞
实验时用完试剂后随手盖上瓶塞
.小红想探究其是否变质,她用小试管取该溶液适量,然后滴加几滴无色酚酞,溶液变红
红
色,她立即判断该溶液没有变质,她的判断正确吗?不正确
不正确
(填“正确”或“不正确”).②小坤用小试管取溶液适量,然后逐滴滴加稀盐酸,开始几滴,并没有发现气泡放出,后来继续滴加时产生了气泡,请你帮他解释开始没有气泡放出的原因?
开始时溶液中含有氢氧化钠或氢氧化钠没有被中和完
开始时溶液中含有氢氧化钠或氢氧化钠没有被中和完
.(4)取15克已部分变质的NaOH固体,加入到50克稀盐酸中,充分反应后,称量剩余物质量只有60.6克,求该固体中含氢氧化钠的质量?
分析:(1)根据碱的组成,溶液酸碱性与pH的关系分析
(2)根据酸的化学性质分析
(3)根据氢氧化钠密封保存的原因分析
(4)根据二氧化碳的质量可求出碳酸钠质量,从而求出氢氧化钠的质量.
(2)根据酸的化学性质分析
(3)根据氢氧化钠密封保存的原因分析
(4)根据二氧化碳的质量可求出碳酸钠质量,从而求出氢氧化钠的质量.
解答:解:(1)氢氧化钠是一种常用的碱,其溶液显碱性,原因是该溶液中含有 OH-离子,该溶液的pH>7.
(2)氢氧化钠溶液显碱性,能使酚酞试液变红,盐酸与活泼金属或碳酸盐反应产生气泡.
(3)①氢氧化钠易与空气中的二氧化碳反应,生成碳酸钠而变质,因此在使用氢氧化钠溶液时要注意:用完试剂后随手盖上瓶塞.因为碳酸钠溶液呈碱性,也能使酚酞试液变红,因此小红方法不正确;
②开始时溶液中含有氢氧化钠,加入盐酸,氢氧化钠与盐酸反应,没有气泡生成,当氢氧化钠完全中和后,碳酸钠与盐酸反应产生气泡.
(4)反应前后总质量的减少量即为生成的二氧化碳的质量,即15g+50g-60.6g=4.4g
设参加反应的Na2CO3质量为x
Na2CO3+2HCl═2NaCl+CO2+2H2O
106 44
x 4.4
=
x=10.6g
则固体中氢氧化钠的质量为15g-10.6g=4.4g.
答:该固体中含氢氧化钠的质量为4.4g.
故答案为:(1)OH->
(2)红 碳酸钠(或锌粒(常用活泼金属))
(3)①CO2 实验时用完试剂后随手盖上瓶塞 红 不正确 ②开始时溶液中含有氢氧化钠或氢氧化钠没有被中和完
(4)4.4g.
(2)氢氧化钠溶液显碱性,能使酚酞试液变红,盐酸与活泼金属或碳酸盐反应产生气泡.
(3)①氢氧化钠易与空气中的二氧化碳反应,生成碳酸钠而变质,因此在使用氢氧化钠溶液时要注意:用完试剂后随手盖上瓶塞.因为碳酸钠溶液呈碱性,也能使酚酞试液变红,因此小红方法不正确;
②开始时溶液中含有氢氧化钠,加入盐酸,氢氧化钠与盐酸反应,没有气泡生成,当氢氧化钠完全中和后,碳酸钠与盐酸反应产生气泡.
(4)反应前后总质量的减少量即为生成的二氧化碳的质量,即15g+50g-60.6g=4.4g
设参加反应的Na2CO3质量为x
Na2CO3+2HCl═2NaCl+CO2+2H2O
106 44
x 4.4
| 106 |
| x |
| 44 |
| 4.4g |
x=10.6g
则固体中氢氧化钠的质量为15g-10.6g=4.4g.
答:该固体中含氢氧化钠的质量为4.4g.
故答案为:(1)OH->
(2)红 碳酸钠(或锌粒(常用活泼金属))
(3)①CO2 实验时用完试剂后随手盖上瓶塞 红 不正确 ②开始时溶液中含有氢氧化钠或氢氧化钠没有被中和完
(4)4.4g.
点评:本题考查酸碱中和反应、氢氧化钠变质原因及碳酸钠的验证实验设计,考查学生分析问题,运用已知知识解决问题的能力.

练习册系列答案
 学期复习一本通学习总动员期末加暑假延边人民出版社系列答案
学期复习一本通学习总动员期末加暑假延边人民出版社系列答案 芒果教辅暑假天地重庆出版社系列答案
芒果教辅暑假天地重庆出版社系列答案
相关题目
 ,根据你的理解,写出丁烷的一个物理性质
,根据你的理解,写出丁烷的一个物理性质 这是一名初三学生用排水法收集好的一瓶无色气体,则集气瓶中的气体可能是
这是一名初三学生用排水法收集好的一瓶无色气体,则集气瓶中的气体可能是