题目内容
大型超市中的许多食物用保鲜膜包装后出售。保鲜膜为什么可以“保鲜”呢?
(设计实验)向A、B、C三只相同的玻璃杯中,分别注入等体积的蒸馏水,并在各玻璃杯外壁标明刻度,第一个玻璃杯用塑料保鲜膜包住杯口,第二个用报纸包住杯口,第三个玻璃杯敞口,如图所示放置一段时间后发现A杯中的水量几乎不变;而C杯中的水量减少较多;B杯中的水量减少比A杯多,比C杯少。根据以上信息回答问题:

(1)从微观角度解释C杯中水量减少的原因为_______________。
(2)保鲜膜除了可以阻止食物中水分流失,还能隔绝氧气防止食物腐败。下列各项措施中利用的原理不是隔绝氧气或空气的是____________(填序号)
A钢铁制品表面涂油漆防锈
B生石灰密封保存防止变质
C白磷放入水中保存防止自燃
D将埋入地下的木桩烤焦以防止腐烂
(3)食品保鲜膜按材质分为聚乙烯化学式(C2H4)n代码PE,聚氯乙烯化学式(C2H3Cl)n代码PVC.PE保鲜膜可直接接触食品,PVC不能直接接触食品,她对人体有潜在的危害,下列有关叙述不正确的是____(填序号)
APE、PVC都属于链状高分子化合物,受热易熔化
B焚烧PVC保鲜膜会放出有毒的气体氯化氢
C废弃的PE和PVC均可以回收利用以减少白色污染
D家中保存西红柿可用PVC保鲜膜
(4)保鲜膜虽然能延长食品的保鲜期,但大量使用后丢弃会造成_______,所以要控制使用。
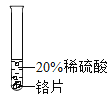
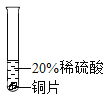
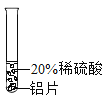
小彬同学家新买了水龙头,从说明书上了解到该水龙头是铜质镀铬的.他想起在学习金属性质时用到的金属活动性顺序中没有铬,为了了解铬与常见金属铝、铜在金属活动性顺序中的相对位置关系,进行如下探究活动.
(预测)三种金属在金属活动性顺序中的相对位置关系:
①Cr>Al>Cu ②Al>Cr>Cu ③Al>Cu>Cr
(实验过程)取大小相同的三种金属薄片,用砂纸打磨光亮.
实验方案 | 实验一
| 实验二
| 实验三
|
实验现象 | 铬片表面产生气泡缓慢,溶液变蓝色. | ____ | 铝片表面产生气泡较快. |
结论 | 铬能和稀硫酸发生反应,反应速率较慢. | 铜不与稀硫酸反应 | ____ |
结论 | 三种金属在金属活动性顺序中的相对位置关系是______(填序号) |
(回答问题)
(1)用砂纸打磨金属片的目的是______.
(2)实验一所发生反应的化学方程式是______(Cr与硫酸反应生成正2价的硫酸盐).
(3)小东提出用硫酸铜溶液代替上述实验中的稀硫酸也能得出三种金属在金属活动性顺序中的相对位置关系,小燕认为不可行,理由是______.
(4)小清认为只要选用三种药品进行实验就可以得出三种金属在金属活动性顺序中的相对位置关系,这三种药品可以是______.
(5)(归纳)比较金属活动性强弱的方法有:①______,②______.
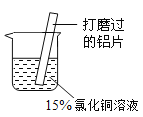
某小组同学在实验室研究铝与氯化铜溶液的反应。
实验操作 | 实验现象 |
| ①红色物质附着于铝片表面 ②铝片表面逸出大量无色气体,放出大量的热 ③烧杯底部出现红色沉淀和白色沉淀 |
(1)打磨铝片的目的是__________________。
(2)现象①和现象③中的红色物质均为Cu,生成该物质的化学方程式为_______________。
(3)经检验,现象②中的无色气体为氢气。小涛猜测可能是氯化铜溶液显酸性.并用pH试纸检验。pH试纸的使用方法是:_______________,把试纸显示的颜色与标准比色卡比较,读出该溶液的pH。测得结果pH______ 7(填“>”、“=”或“ <”),证实了小涛的猜想。
(4)小明通过查阅资料探究白色沉淀的成分,认为可能是氯化亚铜( CuCl)。
[查阅资料]
①CuCl可与浓氨水反应生成无色的Cu(NH3)2+和Cl-。
②Cu( NH3)2+在空气中易被氧化变为蓝色;Cl-可与硝酸银溶液反应,产生白色沉淀。
[进行实验]
①取烧杯底部的白色沉淀,充分洗涤过滤;
③向其中加入浓氨水,沉淀溶解得到无色溶液,并分为两份;
④取其中一份无色溶液
⑤将另一份无色溶液放置于空气中
以上步骤③的实验方案是_____,步骤④的实验现象是____________。
[得出结论]通过实验可以确定,该白色固体是CuCl
[反思与评价]A1和CuCl2溶液反应为什么会出现CuCl呢?
小颖猜测:可能是Cu与CuCl2溶液反应生成了CuCl。
小颖为了验证猜想,取Cu粉与15%CuCl2溶液混合,无白色沉淀产生。
(5)小颖通过分析Al与CuCl2溶液反应的实验现象,改进了实验,从而证明了Cu与CuCl2溶液反应生成了CuCl。改进之处是_________________。


 B.
B. C.
C. D.
D.
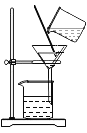 过滤液体 B.
过滤液体 B.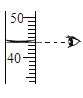 量筒读数
量筒读数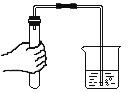 装置气密性检查 D.
装置气密性检查 D. 氧气验满
氧气验满