题目内容
【题目】(7分)“对比实验”是化学学习中行之有效的思维方法。某化学学习小组的同学在学完相关的化学知识后,走进实验室做了如下实验,请你参与并回答下列问题。

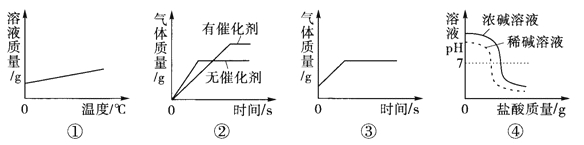
(1)通过实验A,可以说明燃烧的条件之一是 ,实验中使用铜片,是利用了铜的 性(填一条物理性质)
(2)对于实验B,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水
和 直接接触。写一种除去铁锈的方法 。
(3)实验C是利用体积相同并充满CO2的软塑料瓶、等量的水(瓶①)和NaOH溶液(瓶②)进行实验,根据塑料瓶变瘪的程度证明CO2 与NaOH溶液中的溶质确实发生了反应,这一反应的化学方程式为 。
(4)实验D的烧杯②中呈现的现象能说明分子是不断运动的。烧杯②中是酚酞溶液,当烧杯①中液体由浓氨水换成浓盐酸时②中溶液的颜色的变化是 其中盐酸与NaOH的反应属于 反应(填基本反应类型)
【答案】(1)达到燃烧所需的最低温度(或达到着火点) 导热
(2)氧气(或空气) 用稀盐酸(或稀硫酸) (3)CO2 + 2NaOH =Na2CO3 + H2O
(4)无色变红色,红色又逐渐变成无色 复分解反应
【解析】
试题分析:(1)通过实验A的现象:乒乓球碎片燃烧,滤纸片不燃烧,可以说明燃烧的条件之一是达到燃烧所需的最低温度(或达到着火点),实验中使用铜片,是利用了铜的导热性
(2)对于实验B,试管①有水有氧气,试管②有水无氧气,试管③有氧气无水,一段时间后观察到试管①中的铁钉明显锈蚀,由此得出:铁生锈的主要条件是铁与水、氧气(或空气)直接接触,铁锈的主要成分是氧化铁,故用稀盐酸(或稀硫酸)除去铁锈
(3)CO2 与NaOH溶液发生了反应的化学方程式:CO2 + 2NaOH =Na2CO3 + H2O
(4)浓盐酸也具有挥发性,且呈酸性,根据酸碱中和的反应原理,盐酸会中和烧杯②中的氨水,故当烧杯①中液体由浓氨水换成浓盐酸时②中溶液的颜色的变化是无色变红色,红色又逐渐变成无色;盐酸与NaOH的反应是两种化合物相互交换成分生成另两种化合物的反应,属于复分解反应

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】(9分)某兴趣小组同学对实验室制备氧气的条件进行如下探究实验。
(1)为探究催化剂的种类对双氧水分解速度的影响,甲设计以下对比实验:
Ⅰ.将3.0g 10%H2O2溶液与1.0g MnO2均匀混合
Ⅱ.将x g 10%H2O2溶液与1.0g CuO均匀混合
在相同温度下,比较两组实验产生O2的快慢.
Ⅰ中反应的化学方程式是 。
Ⅱ中x的值应为 。
(2)乙探究了影响双氧水分解速度的某种因素.实验数据记录如下:
双氧水的质量 | 双氧水的浓度 | MnO2的质量 | 相同时间内产生O2体积 | |
Ⅰ | 50.0g | 1% | 0.1g | 9mL |
Ⅱ | 50.0g | 2% | 0.1g | 16mL |
Ⅲ | 50.0g | 4% | 0.1g | 31mL |
本实验中,测量O2体积的装置是 (填编号)
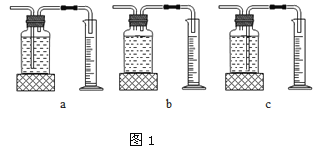
实验结论:在相同条件下, ,双氧水分解得越快。
(3)丙用如图2装置进行实验,通过比较 也能达到实验目的。
【题目】(5分)某化学兴趣小组的学生,发现金属R不在初中学到的金属活动性顺序表中,该小组为了了解R与常见金属铝、铜的金属活动性顺序,进行如下探究活动:
【作出猜想】他们考虑到铝的活动性比铜强,对三种金属的活动性顺序作出如下猜想:
猜想一:Al>Cu>R,猜想二: ,猜想三:R> Al>Cu,
【查阅资料】R是一种银白色的金属,在R的盐溶液中只有+2价R的盐溶液呈蓝色,常温下铝的表面会形成一层致密的氧化膜;硫酸铝、氯化铝、硝酸铝的溶液均为无色。
【实验探究】为了探究哪一种猜想成立,甲、乙、丙三位同学分别针对猜想一、猜想二、猜想三设计实验方案并展开实验探究。
猜想 | 主要操作 | 主要现象 | 实验结论 |
猜想一 | 打磨R丝,并将其插入到硫酸铜溶液中. | R丝表面覆盖了一层红色的物质. | 猜想一 (填“成立”或“不成立”) |
猜想二 | 打磨粗细相同的R丝、铝丝、铜丝,分别将它们插入到体积相同、溶质质量分数也相同的稀硫酸中. | ①R丝表面产生气泡缓慢,溶液由无色逐渐变成蓝色. ②铝丝表面产生气泡较快. ③铜丝表面没有气泡产生. | 猜想二成立. |
猜想三 | 将打磨过的铝丝插入到 溶液中. | 无明显现象. | 猜想三成立 |
 【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后,溶液的颜色 ;进而确认猜想三不成立,猜想二成立。
【交流反思】究竟哪种猜想成立?三位同学经讨论交流,发现丙同学在实验前没有打磨铝丝,这可能会导致实验结论错误。于是他们先打磨铝丝,再将其插入到丙同学做实验用过的溶液中,一段时间后,溶液的颜色 ;进而确认猜想三不成立,猜想二成立。
【归纳总结】探究结束后,他们总结得出:通过金属与 反应或金属与盐溶液反应可以比较金属活动性强弱。