��Ŀ����
����Ŀ��ˮ����Һ�����ǵ�����ϢϢ��ء�
(1)KNO3��NaCl���ܽ��������ͼ����ʾ��20��ʱȡ18gKNO3��18gNaCl�ֱ������ֻ�ձ��У�������50mLˮ(ˮ���ܶȽ��ƿ���1g/cm3)������ܽ⣬������ͼ����ʾ�����µ�50��ʱ��������ͼ����ʾ����ش��������⣺
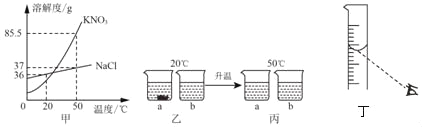
����ͼ�У�a�ձ���Һ�����ʵ���������____b�ձ���Һ�����ʵ���������(ѡ������������������������)��
��Ҫʹ��ͼ�е�NaCl��Һǡ�ñ�ɱ�����Һ����Ҫ����____gNaCl���塣
�۳�ȥ����KNO3�л��е�����NaCl��ʵ�鲽�裺�ȼ�ˮ�����ܽ⣬��____��Ȼ����ˡ�ϴ�ӡ����
�ܰ�������������Ϊ6%��NaCl��Һϡ�ͳ�50g��������Ϊ3%��NaCl��Һ����Ҫˮ�������___mL��������ͼ����ʾ�IJ�������ȡˮ�����(������������ȷ)����������Һ��������������____(ѡ������������������������)3%��
(2)ˮ��һ�ֳ��õ��ܼ������и��������������ˮ�������____(����ĸ)��
A��̼��ƺ��Ȼ��� B������狀��Ȼ��� C���Ȼ�þ���Ȼ��� D���������ƺ��Ȼ���
���𰸡����� 0.5g ���½ᾧ 25 �� ABD
��������
�����ܽ�����߿�֪��20��ʱ���Ȼ��Ƶ��ܽ�ȴ�������أ�50gˮ�м���18g�Ȼ��Ƹպôﵽ����״̬������صõ�������Һ���ұ����й���ʣ�࣬����ͼ��aΪKNO3��Һ��bΪNaCl��Һ��
��1����20��ʱ��������Һ���DZ�����Һ��һ���¶��±�����Һ�����ʷ���=![]() ���ܽ��Խ����������Խ�����ܽ�������е��λ�ÿ�֪���Ȼ�����Һ�������������������������Һ����������������
���ܽ��Խ����������Խ�����ܽ�������е��λ�ÿ�֪���Ȼ�����Һ�������������������������Һ����������������
�ڱ�ͼ��Ϊ50��ʱ����Һ���Ȼ��Ʊ�����Һ�У�50��ʱ�Ȼ��Ƶ��ܽ��Ϊ37g��50��ʱ100g���ܽ�37g�Ȼ��ƣ�50gˮ���ܽ�18.5g�Ȼ��ƣ������0.5g�Ȼ��ƣ�
����Һϡ���������ʵ��������䣬���Լ����ˮ������=50g-50g��3%��6%=25g��ˮ�����=25mL��ͼ�д������Ͽ������Ӷ�����ʵ����ȡ��ˮ�����С��25mL�����յõ�������������������3%��
��2��A��̼��Ʋ���ˮ���Ȼ��ƿ���ˮ���������ʷֱ����ˮ�г���ܽ⣬���γ���Һ�����Ȼ��ƣ������γ���Һ����̼��ƣ��������֣�
B��������ܽ�ʱ���ȣ��Ȼ����ܽ�ʱ��������ЧӦ���������ʷֱ����ˮ�г���ܽ⣬�¶Ƚ��͵�������泥��¶������Ա仯�����Ȼ��ƣ��������֣�
C���Ȼ�þ���Ȼ��ƾ����ܡ���ɫ����������ЧӦ���������ʷֱ����ˮ�г���ܽ⣬�����ԵIJ��죬�������֣�
D�����������ܽ���ȣ��Ȼ����ܽ���������ЧӦ���������ʷֱ����ˮ�г���ܽ⣬�¶����ߵ�������泥��¶������Ա仯�����Ȼ��ƣ��������֡���ѡABD��