题目内容
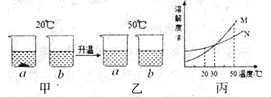
【题目】铝合金是汽车制造中的重要材料之一,查阅资料可知:氢氧化铝沉淀可与氢氧化钠溶液反应,产生可溶性的偏铝酸钠,反应如下: ![]() 。某学习小组取7.8 g该合金粉末加入200.0g过量的盐酸中(假设合金中的其他成分不参与反应),向充分反应后的物质中加入过量20.0%的氢氧化钠溶液。整个实验过程的数据如图所示:
。某学习小组取7.8 g该合金粉末加入200.0g过量的盐酸中(假设合金中的其他成分不参与反应),向充分反应后的物质中加入过量20.0%的氢氧化钠溶液。整个实验过程的数据如图所示:
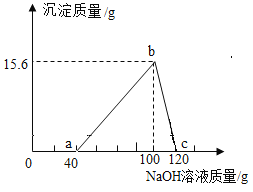
根据图示回答以下问题:
(1)b点时,溶液中的溶质为____________(写化学式)。
(2)该合金中铝的质量为____________g。
(3)加入盐酸的溶质质量分数为____________? (请写出计算过程)
【答案】NaCl 5.4 14. 6%
【解析】
(1)铝合金中加入过量的盐酸,反应后溶液中溶质的种类为氯化铝和氯化氢,0~a段发生的是盐酸与氢氧化钠反应生成氯化钠和水,a~b段发生的是氯化铝与氢氧化钠反应生成氢氧化铝和氯化钠的反应,因此b点时溶液中的溶质为氯化钠;
(2)根据化学反应前后原子种类、质量均不变,可知15.6g氢氧化铝中所含铝元素质量即为7.8 g合金中所含铝的质量,该合金中铝的质量为![]() ;(3)解:设氢氧化钠、铝分别消耗盐酸的溶质质量为x、y
;(3)解:设氢氧化钠、铝分别消耗盐酸的溶质质量为x、y
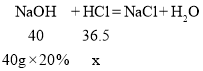
![]()
x=7.3g
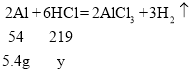
![]()
y=21.9 g
加入盐酸的溶质质量分数为![]()
答:加入盐酸的溶质质量分数为14. 6%。

练习册系列答案
相关题目