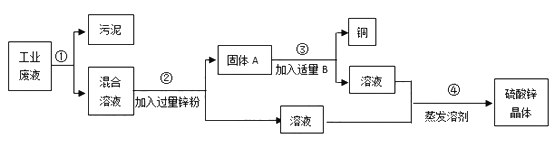
题目内容
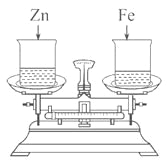
【题目】动自行车、小汽车等交通工具中都有为其提供电能的铅蓄电池(又称“电瓶”),它的优点是可以充电循环使用。电瓶的正极材料是二氧化铅(PbO2),负极材料是金属铅(Pb),电瓶内所加液体是溶质质量分数为36%的稀硫酸,放电(为外界供电)时发生反应的化学方程式如下:PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O。当放电时,反应物反应掉一定量后,就会导致电压下降,不能正常使用,这时就必须及时充电。
(1)电瓶在放电时,_________能转化为电能。
(2)假如某个电瓶中铅的质量为1800 g,内装36%的稀硫酸1200 g,当有310.5 g的铅参加反应时,需消耗稀硫酸中溶质_____克?此时电瓶中硫酸溶液溶质的质量分数是_____?(最后结果精确到0. 01%)
【答案】 化学 294g 14.38%
【解析】(1)放电时的电能由反应PbO2(固)+2H2SO4+Pb=2PbSO4(固)+2H2O而产生,因此此过程为化学能转变为电能的过程;(2)设需消耗硫酸的质量为x,同时生成水的质量为y;PbO2(固)+2H2SO4+Pb=2PbSO4↓+2H2O
196 207 36
x 310.5g y
![]() ,
,![]()
x=294g,y=54g,
36%的稀硫酸1200克稀硫酸中硫酸的质量=1200g×36%=432g,则反应后还剩余硫酸的质量=432g-294g=138g;剩余硫酸溶液的质量=1200g-294g+54g=960g;
硫酸溶液溶质的质量分数=![]() ×100%=14.38%。
×100%=14.38%。

练习册系列答案
 一诺书业暑假作业快乐假期云南美术出版社系列答案
一诺书业暑假作业快乐假期云南美术出版社系列答案
相关题目