题目内容
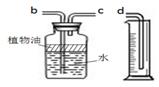
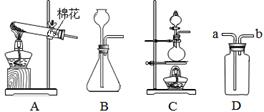
(7分)下面所示(如图)为常见气体制备、干燥和性质实验的部分仪器。试根据题目要求,回答下列问题: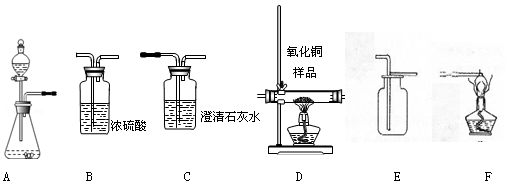
(1)欲在实验室中用过氧化氢和二氧化锰制备并收集干燥的氧气。
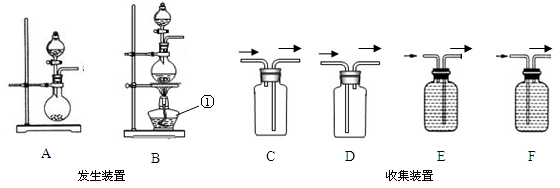
①所选仪器的连接顺序为___________(填写仪器序号字母);
②仪器A中,发生反应的化学方程式为________________________,二氧化锰所起的作用为_______________;
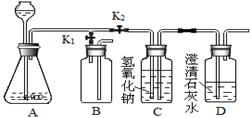
(2)欲用含有少量二氧化碳的一氧化碳气体测定某10g不纯氧化铜样品的纯度(杂质不反应),并验证反应中气体生成物的性质。所选仪器的连接顺序为:混合气体→D→C→F。
①装置D中可以观察到现象为___________________________________________;
②仪器C的作用是_____________________________________________________;
③通过测量反应后D装置的质量减少了1.6g,则样品中氧化铜的质量为_________________;
④如果用上述C装置反应前后质量的变化,来计算氧化铜的纯度,则计算结果将___________ (填“偏大”“偏小”“不影响”其中之一)。
(1)①ABE ②2H2O2MnO22H2O+O2  催化作用
催化作用
(2)①黑色粉末变为红色 ②检验生成的二氧化碳气体
③ 8g ④偏大
解析试题分析:(1) ①用过氧化氢和二氧化锰制取氧气应用固体和液体在常温下制取气体的装置,所以应用装置A。浓硫酸有吸水性,可作干燥剂,所以可用装置B。氧气的密度比空气大,且题目要求收集干燥的氧气,所以应选向上排空气法收集氧气,使用装置E。所以应选择ABE三个装置完成实验。
②仪器A中,过氧化氢在二氧化锰的催化作用下发生分解反应生成水和氧气;反应的化学方程式为2H2O2MnO22H2O+O2  ;
;
(2)欲用含有少量二氧化碳的一氧化碳气体测定某10g不纯氧化铜样品的纯度(杂质不反应),并验证反应中气体生成物的性质。所选仪器的连接顺序为:混合气体→D→C→F。
①装置D中一氧化碳可与氧化铜反应生成铜和二氧化碳;所以可以观察到黑色粉末变为红色。
②仪器C中的氢氧化钙可与生成的二氧化碳反应生成碳酸钙沉淀;可通过是否有沉淀产生确认反应的生成物中是否有二氧化碳气体。
③反应后D装置的质量减少了1.6g,即氧化铜中氧元素的质量为1.6g。根据氧化铜的化学式CuO氧元素的质量分数可求出氧化铜的质量。具体过程为:样品中氧化铜的质量为1.6g÷(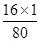 ×100%)=8g;
×100%)=8g;
④ C装置可与二氧化碳反应。根据题意可知:二氧化碳有两部分,1混合气体中的二氧化碳;2反应生成的二氧化碳;所以C装置测得的二氧化碳的质量偏大。用此数据计算则可使计算结果偏大
考点:气体的制取、净化和收集、一氧化碳还原氧化铜、装置误差分析

 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
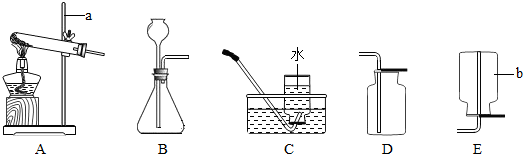
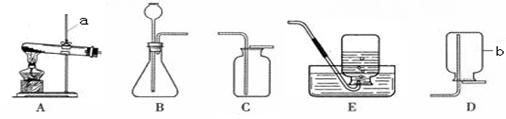
步步高口算题卡系列答案(9分)请结合下列实验常用装置,回答有关问题。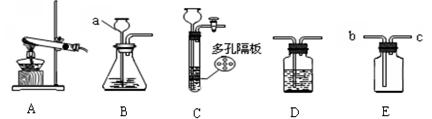
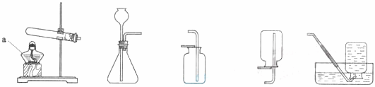
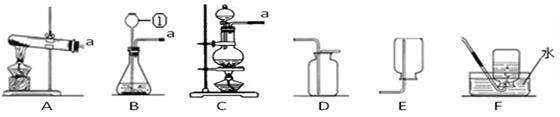
(1)写出图中标有字母的仪器的名称:a 。
(2)实验室用高锰酸钾制取氧气,应选用的发生装置 ,反应的化学方程式是 。
(3)比较用过氧化氢溶液和用高锰酸钾制取O2的方法,两者的共同点是 (填序号)。
| A.发生装置相同 | B.都可用MnO2作催化剂 |
| C.反应的基本类型相同 | D.完全反应后剩余固体成分相同 |
(5)实验室常用装置C代替装置B制取气体,该装置的优点是 ,下列反应适用于该装置的是 (填序号)。
①大理石和稀盐酸 ②碳酸钠固体和稀硫酸
③锌粒与稀硫酸 ④过氧化氢溶液与二氧化锰
 MnCl2+Cl2↑+2H2O,选择的发生装
MnCl2+Cl2↑+2H2O,选择的发生装