题目内容
某制碱石用岩盐水精制后的食盐水为原料生产的纯碱产品中会含有少量氯化钠杂质,该制碱厂的产品包装袋上注明:碳酸钠含量≥96%.为测定该纯碱产品的纯度(其中所含杂质不与酸反应),某同学按如下流程进行实验:用盐酸溶解产品→干燥所得气体→用NaOH吸收所得气体→根据NaOH溶液的增重计算产品的纯度(实验过程中所取纯碱样品的质量为18.0g),实验装置如图所示: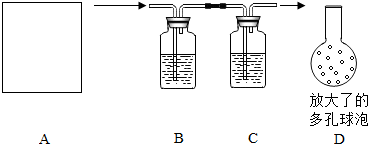
(1)A为溶解产品的装置(未画出),若已准备了长颈漏斗、双孔橡皮塞、导气管,为完成溶解至少还需要的实验仪器是 .
(2)B中所盛的试剂是 .
(3)根据上述装置进行实验,下列情况会使结果产生偏差的是
A、进入C装置的气体中还混有少量HCl气体
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收
C、实验结束时,系统内还残留少量CO2气体
D、实验开始后连接A、B装置进行实验
(4)将B、C装置中插入溶液的导气管的下端改成具有多孔的球泡D,有利于提高实验的准确度,其理由是 .
(5)改进实验装置并进行正确操作可以准确测定出产品的纯度,若此时装置C的实验前后其质量增加了6.6g,该产品是否合格?(要求写出计算过程,结果精确到0.1%)

(1)A为溶解产品的装置(未画出),若已准备了长颈漏斗、双孔橡皮塞、导气管,为完成溶解至少还需要的实验仪器是
(2)B中所盛的试剂是
(3)根据上述装置进行实验,下列情况会使结果产生偏差的是
A、进入C装置的气体中还混有少量HCl气体
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收
C、实验结束时,系统内还残留少量CO2气体
D、实验开始后连接A、B装置进行实验
(4)将B、C装置中插入溶液的导气管的下端改成具有多孔的球泡D,有利于提高实验的准确度,其理由是
(5)改进实验装置并进行正确操作可以准确测定出产品的纯度,若此时装置C的实验前后其质量增加了6.6g,该产品是否合格?(要求写出计算过程,结果精确到0.1%)
考点:实验探究物质的组成成分以及含量,常见气体的检验与除杂方法,盐的化学性质,根据化学反应方程式的计算
专题:科学探究
分析:(1)欲知为了完成溶解至少还需要的实验仪器是什么,须知此实验共须哪些仪器;
(2)浓硫酸具有吸水性,可做干燥剂.
(3)欲正确选择,须牢记实验须注意的事项;
(4)将插入溶液的管子的下端改成具有多孔的球泡后可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)C瓶中多出的质量是吸收生成的CO2的质量,根据方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可计算出Na2CO3的质量,根据碳酸钠的质量分数可计算出其质量分数.
(2)浓硫酸具有吸水性,可做干燥剂.
(3)欲正确选择,须牢记实验须注意的事项;
(4)将插入溶液的管子的下端改成具有多孔的球泡后可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)C瓶中多出的质量是吸收生成的CO2的质量,根据方程式Na2CO3+2HCl=2NaCl+H2O+CO2↑可计算出Na2CO3的质量,根据碳酸钠的质量分数可计算出其质量分数.
解答:解:(1)要完成此实验,需要的实验仪器有长颈漏斗、双孔橡胶塞、导气管、广口瓶(或锥形瓶、大试管、烧瓶),故答案为:广口瓶(或锥形瓶、大试管、烧瓶);
(2)浓硫酸具有吸水性,可做干燥剂.故B中所盛的试剂是浓硫酸;故填:浓硫酸;
(3)A、进入C装置的气体中还混有少量HCl气体,说明在前面的反应过程中没有完全反应,会使计算结果不准确;
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收,会使计算结果不准确;
C、实验结束时,系统内还残留有少量CO2气体,说明CO2没有被NaOH溶液全部吸收,会使计算结果不准确;
D、实验开始A、B装置以及导气管内残留有少量空气,这样溶液使实验不精确,不能正确计算反应物的生成;故选:ABCD;
(4)多孔的球泡可以增大气体与溶液的接触面积,使气体被充分吸收,有利于提高实验的准确度.故答案为:可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)解:设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
=
解得x=15.9g
样品中碳酸钠的质量分数为
×100%=88.3%<96%,所以产品不合格.
答:该产品不合格.
(2)浓硫酸具有吸水性,可做干燥剂.故B中所盛的试剂是浓硫酸;故填:浓硫酸;
(3)A、进入C装置的气体中还混有少量HCl气体,说明在前面的反应过程中没有完全反应,会使计算结果不准确;
B、气体通过速度过快,CO2来不及被NaOH溶液全部吸收,会使计算结果不准确;
C、实验结束时,系统内还残留有少量CO2气体,说明CO2没有被NaOH溶液全部吸收,会使计算结果不准确;
D、实验开始A、B装置以及导气管内残留有少量空气,这样溶液使实验不精确,不能正确计算反应物的生成;故选:ABCD;
(4)多孔的球泡可以增大气体与溶液的接触面积,使气体被充分吸收,有利于提高实验的准确度.故答案为:可以增大气体与溶液的接触面积,使气体被充分吸收;
(5)解:设样品中碳酸钠的质量为x
Na2CO3+2HCl=2NaCl+H2O+CO2↑
106 44
x 6.6g
| 106 |
| x |
| 44 |
| 6.6g |
解得x=15.9g
样品中碳酸钠的质量分数为
| 15.9g |
| 18.0g |
答:该产品不合格.
点评:本题主要测试学生对实验操作的掌握和物质纯度的计算,学生必须牢记操作实验步骤和注意事项,并能熟练运用质量分数公式进行计算,才能正确解答.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
用试管加热固体物质时,有时因操作不正确出现试管炸裂现象.某同学寻找出下列原因,其中不正确的是( )
| A、加热前试管外壁的水未擦干 |
| B、加热不均匀,局部温度过高 |
| C、加热完,没有冷却即用冷水冲洗 |
| D、加热时试管夹夹得过紧 |


 如图为浓盐酸的试剂瓶包装标签上的部分文字.请仔细阅读后回答以下问题:
如图为浓盐酸的试剂瓶包装标签上的部分文字.请仔细阅读后回答以下问题: