题目内容
某科研小组预测定孔雀石中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.现称取30g该孔雀石样品放入烧杯中,再逐滴加入稀盐酸至恰好完全反应,反应的化学方程式为:铜Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O.共消耗该稀盐酸146g(假设杂质不与稀盐酸反应,也不溶于水),最终称得烧杯中剩余物质的质量为171.6g.试求:
(1)孔雀石中碱式碳酸铜的质量分数;
(2)所得溶液中溶质的质量分数.(结果保留至0.1%)
解:(1)依题意,CO2的质量=30g+146g-171.6g=4.4g.
设孔雀石中碱式碳酸铜的质量为x,生成氯化铜质量为y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 270 44
x y 4.4g
 =
= x=22.2g
x=22.2g
 =
= y=27g
y=27g
∴孔雀石中碱式碳酸铜的质量分数为 ×100%=74%.
×100%=74%.
(2)根据(1)的计算可知,反应后溶液的质量=171.6g-(30g-22.2g)=163.8g.
∴所得溶液中溶质的质量分数=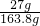 ×100%≈16.5%.
×100%≈16.5%.
答:孔雀石中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.
分析:(1)依据质量守恒定律算出生成二氧化碳的质量,然后据化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,并计算孔雀石中碱式碳酸铜的质量分数;
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,计算出溶液中溶质的质量分数.
点评:掌握化学方程式的计算格式和规范性,以及溶质质量分数的计算方法是解答此题的关键,本题的易错点是反应后溶液质量要减去杂质的质量.
设孔雀石中碱式碳酸铜的质量为x,生成氯化铜质量为y.
Cu2(OH)2CO3+4HCl=2CuCl2+CO2↑+3H2O
222 270 44
x y 4.4g
 =
= x=22.2g
x=22.2g =
= y=27g
y=27g∴孔雀石中碱式碳酸铜的质量分数为
 ×100%=74%.
×100%=74%.(2)根据(1)的计算可知,反应后溶液的质量=171.6g-(30g-22.2g)=163.8g.
∴所得溶液中溶质的质量分数=
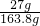 ×100%≈16.5%.
×100%≈16.5%.答:孔雀石中碱式碳酸铜的质量分数为74%;所得溶液中溶质的质量分数为16.5%.
分析:(1)依据质量守恒定律算出生成二氧化碳的质量,然后据化学方程式并代入二氧化碳气体的质量计算出碱式碳酸铜的质量,并计算孔雀石中碱式碳酸铜的质量分数;
(2)根据化学方程式计算出氯化铜的质量,然后计算出反应后溶液的质量,计算出溶液中溶质的质量分数.
点评:掌握化学方程式的计算格式和规范性,以及溶质质量分数的计算方法是解答此题的关键,本题的易错点是反应后溶液质量要减去杂质的质量.

练习册系列答案
 同步练习河南大学出版社系列答案
同步练习河南大学出版社系列答案 同步练习西南师范大学出版社系列答案
同步练习西南师范大学出版社系列答案 补充习题江苏系列答案
补充习题江苏系列答案 学练快车道口算心算速算天天练系列答案
学练快车道口算心算速算天天练系列答案
相关题目
 (2012?湖州)我市某公司研制出了一种新颖的“装饰树”.
(2012?湖州)我市某公司研制出了一种新颖的“装饰树”.