题目内容
【题目】甲物质的溶液可用作电镀液等。甲的溶解度曲线如右图所示,下列说法正确的是( )
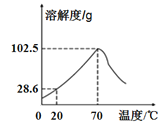
A.甲的溶解度是102.5g
B.甲的溶解度随温度的升高而增大
C.20℃时,100 g甲的饱和溶液中溶质质量为28.6 g
D.将70℃甲的饱和溶液升温或降温,都有晶体析出
【答案】D
【解析】
试题分析:A、物质的溶解度随温度变化而变化,未确定温度无法确定溶解度,说法错误;
B、低于70℃时,甲的溶解度随温度升高而升高,但大于70℃时,随温度的升高而降低,说法错误;
C、20℃时,甲的溶解度为28.6g,即100g水溶解28.6g甲形成128.6g饱和溶液,那么100g该温度下的饱和溶液中溶质一定少于28.6g,说法错误;
D、70℃甲的饱和溶液升温或降温,溶解度都下降,都会有晶体析出,说法正确。

 黄冈小状元解决问题天天练系列答案
黄冈小状元解决问题天天练系列答案 三点一测快乐周计划系列答案
三点一测快乐周计划系列答案【题目】“化学反应条件的控制是实验的灵魂”。某探究小组发现若反应过快,产生的气体不易及时收集,为探究影响过氧化氢溶液分解快慢的因素,于是进行了如下探究:
【提出问题】过氧化氢溶液分解快慢与哪些因素有关呢?
【猜想与假设】猜想一:可能与过氧化氢的质量分数有关;
猜想二:可能与 有关;
猜想三:可能与是否用催化剂有关。
【设计并实验】该探究小组用不同质量分数的过氧化氢溶液在不同温度时进行四次实验.记录所生成的氧气体积和反应所需时间,记录数据如下表.
实验 | 过氧化氢的 | 过氧化氢溶液 | 温度 | 二氧化锰 | 收集氧气 | 反应所需 |
① | 5% | 1 | 20 | 0.1 | 4 | 16.75 |
② | 15% | 1 | 20 | 0.1 | 4 | 6.04 |
③ | 30% | 5 | 35 | 2 | 49.21 | |
④ | 30% | 5 | 55 | 2 | 10.76 |
【收集证据】要比较不同质量分数的过氧化氢溶液对反应快慢的影响,应选择的实验编号组合是
(选填“实验序号”)。由实验③和④对比可知,化学反应速率与温度的关系是: 。
【解释与结论】(1)通过探究,了解控制过氧化氢分解快慢的方法。请写出过氧化氢溶液在二氧化锰的催化作用下生成氧气的化学方程式为: 。(2)用一定量15%的过氧化氢溶液制氧气,为了减缓反应速率,可加适量的水稀释,所产生氧气的总质量 。(填“减小”、“增大”或“不变”)