题目内容
【题目】已知,无水![]() 在
在![]() 时可发生如下反应:
时可发生如下反应:![]() 。取
。取![]() 无水
无水![]() ,在
,在![]() 时充分加热,使之完全分解。将产生的气体产物通入足量浓硫酸(已知
时充分加热,使之完全分解。将产生的气体产物通入足量浓硫酸(已知![]() 气体不能被浓硫酸吸收),浓硫酸质量增加
气体不能被浓硫酸吸收),浓硫酸质量增加![]() ,再通过
,再通过![]() 溶液,
溶液,![]() 溶液质量增加
溶液质量增加![]() 。则下列说法正确的是( )
。则下列说法正确的是( )
A.![]() 化学式可能是
化学式可能是![]() B.剩余固体的质量为
B.剩余固体的质量为![]()
C.生成![]() 和
和![]() 气体的总质量为
气体的总质量为![]() D.方程式中
D.方程式中![]()
【答案】B
【解析】
A、反应物种没有氢元素,则X的化学式不可能是H2O;故选项错误。
B、根据质量守恒定律可以知道,剩余固体的质量为152g-40g-32g=80g;故选项正确。
C、浓硫酸质量增加40g,增加的是X的质量,再通过NaOH溶液,NaOH溶液质量增加32g,增加的是二氧化硫的质量,因此生成二氧化硫和X气体的总质量为40g+32g=72g,故选项错误;
D、根据质量守恒定律可知,硫原子个数反应前后不变,若X中不含有硫元素,则a:c=1:1,若X中含有硫元素,则a:c≠1:1;故选项错误。
故选:B。

【题目】实验设计是化学实验的重要环节,请根据下列实验要求回答相关问题:
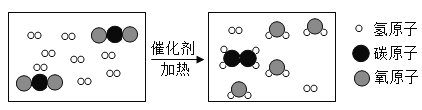
(活动与探究一)下图所示是用对比实验方法探究二氧化碳的性质。
实验一 | 实验二 |
|
|
实验一:振荡3个矿泉水塑料瓶,观察到塑料瓶变瘪的程度为A>B>C。其中B瓶石灰水变浑浊,此反应的化学方程式为____________________;对比A瓶与____(选填“B”或“C”)瓶的塑料瓶变瘪的程度,可证明二氧化碳能与氢氧化钠发生反应。
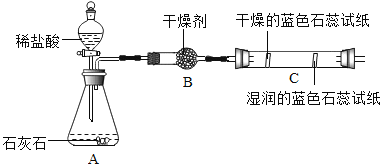
实验二:观察到C装置中发生的现象是:干燥的蓝色石蕊试纸______,湿润的蓝色石蕊试纸_______;此实验可证明二氧化碳能与水发生反应,此反应的化学方程式是_______________________。
(活动与探究二)下图所示是用控制变量法探究影响物质溶解性的因素。
实验三 | 实验四 |
|
|
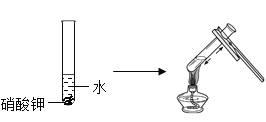
实验三:该实验的目的是探究____________对硝酸钾溶解性的影响。
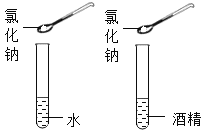
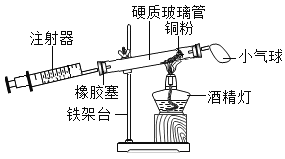
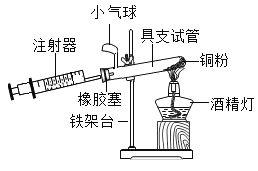
实验四:观察到的现象为氯化钠溶解于水中,不能溶解于酒精中。该实验的目的是探究__________________。(活动与探究三)下图所示是定量测定空气中氧气的含量。
实验五 | |
装置一 |
装置二 |
实验五:①装置一和装置二中气球的位置不同,装置一设计优于装置二的理由:_____________________________。
②根据下表提供的实验数据,回答问题:
硬质玻璃管的容积 | 反应前注射器中气体体积 | 反应后注射器中气体体积 | 实验测得空气中 氧气的体积分数 |
30mL | 20 mL | 12 mL | ______%(填写数值) |
③定量实验操作中易产生误差,如果反应前气球中存在少量气体(其量小于注射器内的空气),而实验后冷却至室温,将气球内的气体全部挤出读数,导致实验测得结果______(选填“偏小”、“偏大”或“无影响”)。