题目内容
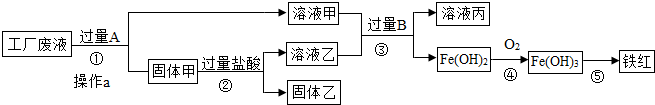
某工厂废液中含有氯化钠、氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素.设计实验方案如图所示.
回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是 .
(2)工厂废液中加入过量A反应的化学方程式为 .
(3)固体乙的主要成分是 .
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为 .
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收集到0.2g氢气(杂质不参加反应).则该生铁样品中铁的质量分数为 .(列出
计算过程,保留一位小数.)

回答下列问题:
(1)加入过量A溶解后,再进行操作a时玻璃棒的作用是
(2)工厂废液中加入过量A反应的化学方程式为
(3)固体乙的主要成分是
(4)铁红是炼铁的主要原料,用CO和铁红炼铁的化学方程式为
(5)某研究性学习小组的同学为了测定某钢铁厂生铁样品中铁的质量分数,在实验室中
称取生铁样品5.8g放入烧杯中,然后再加入足量的稀硫酸,使之充分反应后,共收集到0.2g氢气(杂质不参加反应).则该生铁样品中铁的质量分数为
计算过程,保留一位小数.)
分析:向废水中加入过量的铁,可以把铜还原出来,过滤得到铜、铁.再向固体中加入过量的盐酸,可以把铁除去.这时的固体中只含有铜;溶液甲中含有溶质氯化亚铁和氯化钠,溶液乙中含有氯化亚铁和盐酸,向其加入过量的B,氯化亚铁全部和氢氧化钠反应生成氢氧化亚铁沉淀.
解答:解:废液中含有氯化钠、氯化铜和氯化亚铁,由于目的是获得铜和铁红,所以需要在过程中铜离子转化为铜单质,根据流程可以看成铜应该出现在固体甲中,所以A就是转化铜离子用的铁粉,为使铜离子彻底转化,所以应该加入过量的铁粉.这样导致固体甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉,溶液乙为生成的氯化亚铁和剩余的盐酸.而溶液甲为氯化钠和生成的氯化亚铁.溶液甲和乙加入过量的B后生成氢氧化亚铁,说明B为氢氧化钠等可溶性碱.
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.
(2)加入过量的A是铁与氯化铜反应化学方程式为,Fe+CuCl2=FeCl2+Cu
(3)由上述分析可知甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉.
(4)铁红(主要成分Fe2O3),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;化学方程式为3CO+Fe2O3
2Fe+3CO2
(5)生铁的主要成分是铁,铁与硫酸反应生成硫酸亚铁和氢气,根据化学方程式中已知氢气的质量可求出铁的质量,从而求出生铁中铁的质量分数.
设参加反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
=
解得:x=5.6g
生铁中铁的质量分数=
×100%=96.6%
故答案为:(1)引流(2)Fe+CuCl2═FeCl2+Cu(3)铜(4)3CO+Fe2O3
2Fe+3CO2
(5)96.6%
(1)过滤可以除去不溶于水的物质,玻璃棒起引流作用.
(2)加入过量的A是铁与氯化铜反应化学方程式为,Fe+CuCl2=FeCl2+Cu
(3)由上述分析可知甲为生成的铜和剩余的铁粉.当加入过量盐酸时,使铁粉完全从铜粉中除掉,所以固体乙是纯净的铜粉.
(4)铁红(主要成分Fe2O3),所以判定出反应物是氧化铁和一氧化碳,根据所学知识生成物应是铁和二氧化碳;化学方程式为3CO+Fe2O3
| ||
(5)生铁的主要成分是铁,铁与硫酸反应生成硫酸亚铁和氢气,根据化学方程式中已知氢气的质量可求出铁的质量,从而求出生铁中铁的质量分数.
设参加反应的铁的质量为x
Fe+H2SO4═FeSO4+H2↑
56 2
x 0.2g
| 56 |
| x |
| 2 |
| 0.2g |
解得:x=5.6g
生铁中铁的质量分数=
| 5.6g |
| 5.8g |
故答案为:(1)引流(2)Fe+CuCl2═FeCl2+Cu(3)铜(4)3CO+Fe2O3
| ||
(5)96.6%
点评:本题主要考查了玻璃棒的作用:(溶解中其加速溶解的作用、过滤中起引流的作用、蒸发中起使其受热均匀地作用);书写化学方程式的配平,判断某种物质是否过量等方面的内容.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目






