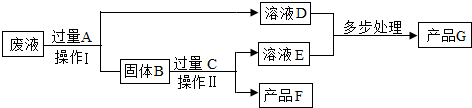
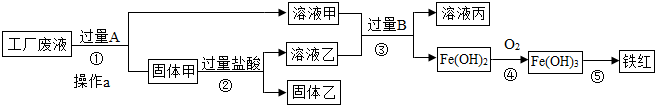
题目内容
某工厂废液中含有氯化钠.氯化铜和氯化亚铁.某课外小组要从废液中回收铜并得到铁红(主要成分Fe2O3),要求全过程不引入其他金属元素.设计实验方案如图所示,回答下列问题.
(1)②加入过量盐酸的目的是
(2)工厂废液中加入过量A反应的化学方程式为
(3)溶液甲中的金属离子是

(1)②加入过量盐酸的目的是
把过量的金属A,即铁粉除去
把过量的金属A,即铁粉除去
.(2)工厂废液中加入过量A反应的化学方程式为
Fe+CuCl2=FeCl2+Cu
Fe+CuCl2=FeCl2+Cu
.(3)溶液甲中的金属离子是
Na+、Fe2+
Na+、Fe2+
(写离子符号).分析:根据题目给出的信息:要从废液中回收铜并得到铁红,要求全过程不引入其他金属元素,因此向废液中加入过量的铁粉,铁和硫酸铜反应生成硫酸亚铁和铜,铁与氯化钠溶液不反应;过滤后,溶液甲是氯化钠和氯化亚铁的混合物,因此阳离子是钠离子和亚铁离子;固体甲是铜和过量的铁.
解答:解:(1)要从废液中回收铜并得到铁红,要求全过程不引入其他金属元素,因此向废液中加入过量的铁粉,从而得到金属铜,故答案为:把过量的金属A,即铁粉除去
(2)铁和硫酸铜反应生成硫酸亚铁和铜,故答案为:Fe+CuCl2=FeCl2+Cu
(3)过滤后,溶液甲是氯化钠和氯化亚铁的混合物,因此阳离子是钠离子和亚铁离子;故答案为:Na+、Fe2+
(2)铁和硫酸铜反应生成硫酸亚铁和铜,故答案为:Fe+CuCl2=FeCl2+Cu
(3)过滤后,溶液甲是氯化钠和氯化亚铁的混合物,因此阳离子是钠离子和亚铁离子;故答案为:Na+、Fe2+
点评:考点考查了物质的制备,物质的制备有一下几种类型:一种是只能用题目给出的原料来制取;一种是自己选取原料来制备新物质;还有的是给你一部分药品,其它自选等.本题结合物质的性质,灵活应用,答案就会迎刃而解.

练习册系列答案
相关题目