题目内容
【题目】溶洞都分布在石灰岩组成的山洞中,石灰岩的主要成分是碳酸钙,当遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙:CaCO3+CO2+H2O=Ca(HCO3)2。某化学兴趣小组同学们思考:若向碳酸钠溶液中通入一定量二氧化碳,是否能生成碳酸氢钠(NaHCO3)?于是他们开始实验探究。(不考虑二氧化碳和碳酸作为溶质的情况)
(提出问题)
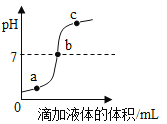
所得溶液中所含溶质成分是什么?
(查阅资料)
(1)碳酸氢盐[如Ca(HCO3)2、Ba(HCO3)2、NaHCO3]都能溶于水
(2)Na2CO3、NaHCO3的溶液呈碱性、BaCl2溶液呈中性
(提出猜想)
猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为_____。
(实验验证)
实验步骤 | 实验现象 | 实验结论 |
(1)取反应后溶液少许于试管中,滴加几滴_____试液; | 溶液变红色 | 该溶液显碱性 |
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液; | 有白色沉淀生成 | 猜想_____不成立 |
(3)_____ | _____ | 猜想三成立 |
(得出结论)猜想三成立,证明二氧化碳通入碳酸钠溶液生成了碳酸氢钠。
(拓展应用)同学们回忆实验室用澄清石灰水检验二氧化碳的情景,结合上述知识,如果向一定量的澄清石灰水中不断通入二氧化碳气体,下列哪一个图像能正确反映生成的碳酸钙沉淀与二氧化碳的质量之间的变化关系_____(填字母序号)。
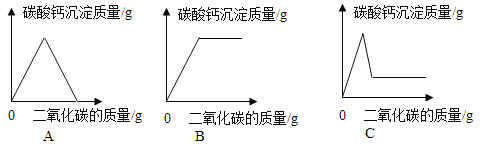
【答案】Na2CO3和NaHCO3 酚酞 二 取适量实验步骤(2)中反应后试管中的上层清液,滴加稀盐酸 产生气泡 A
【解析】
[提出猜想]
根据题中提供的信息,碳酸钙遇到溶有二氧化碳的水时,会反应生成溶解性较大的碳酸氢钙。碳酸钠和碳酸钙一样也是碳酸盐,向碳酸钠溶液中通入一定量二氧化碳,也能生成碳酸氢钠。因此向碳酸钠溶液中通入一定量二氧化碳后得到的溶液中溶质可能是:碳酸钠没有反应、部分反应或全部反应。具体情况为:
猜想一:溶质为Na2CO3;猜想二:溶质为 NaHCO3;猜想三:溶质为Na2CO3和NaHCO3。
[实验验证]
(1)实验现象:溶液变红色,实验结论:该溶液显碱性。遇碱性溶液变红的指示剂是无色酚酞溶液,因此该实验步骤中向反应后溶液中滴加的是无色酚酞溶液;
(2)取反应后溶液少许于试管中,向其中滴加过量的BaCl2溶液;实验现象是:有白色沉淀生成。根据题中提供的信息,碳酸氢盐[如Ca(HCO3)2、Ba(HCO3)2、NaHCO3]都能溶于水,实验中有白色沉淀生成,则溶液中一定有碳酸钠,因为碳酸钠和BaCl2溶液反应能生成碳酸钡沉淀,故猜想二不成立;
(3)实验(3)的结论是猜想三成立。因为实验(2)已经证明溶液中含有碳酸钠,所以只要证明溶液中还含有NaHCO3就行,而实验(2)中加入过量的BaCl2溶液后,溶液中碳酸钠已经被除尽,且氯化钡溶液呈中性,因此实验(3)的步骤是:取适量实验步骤(2)中反应后试管中的上层清液,滴加稀盐酸;因为碳酸氢钠和稀盐酸反应产生二氧化碳气体,所以该实验的现象是:产生气泡。
[拓展应用]
如果向一定量的澄清石灰水中不断通入二氧化碳气体,应该是首先发生二氧化碳和氢氧化钙溶液的反应,反应中生成碳酸钙沉淀,随着二氧化碳的增加沉淀质量不断增加,氢氧化钙反应完时生成的碳酸钙质量达到最大值;如果继续通入二氧化碳,碳酸钙沉淀就会和二氧化碳及水反应生成能溶于水的Ca(HCO3)2,沉淀质量就不断减小,直至为0。故能正确反映生成的碳酸钙沉淀与二氧化碳的质量之间的变化关系的图像是:A。图像B中碳酸钙质量达到最大值后,继续通入二氧化碳,碳酸钙质量不变,应该逐渐减少直至为0,关系不正确;图像C中碳酸钙质量减少到一定数值后,不再变化,应该最后为0,关系不正确。

【题目】铁及其化合物在生活生产中应用非常广泛。
(一)铁材料的有关知识

(1)人类使用金属先后经历了“青铜”、“铁器”时代,直到近代才开始大量使用铝材料。这也反映出Cu、Fe、 Al三种金属的活动性由强到弱的顺序是_______________。
(2)磁铁矿是早期司南(如图)的材料,磁铁矿中所含铁的氧化物主要是________________。
(3)我国C919大型客机去年惊艳亮相,客机上大规模使用碳纤维复合材料、铝锂合金、铁钛合金、纳米陶瓷等先进材料,其中不涉及到的材料是_________(选填序号)。
A 合金
B 无机非金属材料
C 合成材料
D 复合材料
(4)铁矿石有赤铁矿、磁铁矿、黄铁矿(FeS2)等。工业上用黄铁矿制取硫酸而不用于炼铁,不用于炼铁原因是:①冶炼中产生SO2污染环境;②______________。
(二)制取碱式硫酸铁
碱式硫酸铁是-种废水处理剂,用硫酸厂的废渣(主要成分为铁的氧化物、少量FeS及SiO2)制备碱式硫酸铁晶体[Fe4(OH)2(SO4)5·6H2O]主要流程如下:

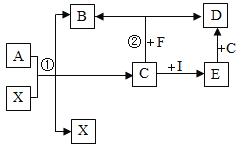
(1)废渣应研磨成粉末,目的是_____。
(2)“酸溶”过程中生成H2S气体的化学方程式为________
(3)过滤后洗涤,证明固体已洗净的方法是_______。
(4)“转化”发生反应的化学方程式为_______,该反应温度不宜过高的原因是________。
(三)碱式硫酸铁晶体的热分解实验
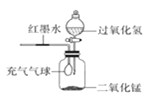
兴趣小组称取此晶体样品25.38g,在科研人员的指导下用下图装置进行热分解实验。
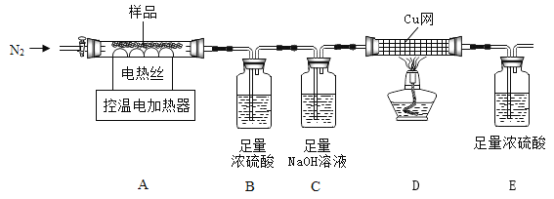
[查阅资料]①碱式硫酸铁晶体(相对分子质量为846)200°C完全分解生成Fe2O3、H2O和Fe2(SO4)3;
②Fe2(SO4)3在500°C完全分解为Fe2O3、SO2、SO3和O2;
③B装置中浓硫酸只能吸收SO3和H2O。.
(1)装配好实验装置后,先要_________。
(2)加热前后及过程中均通入N2,停止加热后继续通N2的目的是防止倒吸和______。
(3)控制不同的温度对A中固体加热,测得装置B、C和D中的质量变化如下表,测得剩余固体质量随温度的变化如图所示。

温度/C | 室温 | 220 | 520 |
B装置/g | 200.00 | 203.78 | 207.78 |
C装置/g | 200.00 | 200.00 | x |
D装置/g | 100.00 | 100.00 | 101.60 |
①如图中m1=____________。
②表格中x=_____________。
③将最终的剩余固体继续加热到更高的温度,发现固体减少0.32g后质量不再改变,写出此过程中发生反应的化学方程式____________。
【题目】某小组用图表对所学知识进行归纳,其中甲包含乙和丙,不包含丁(如图所示)。下列表格中的各组物质或变化符合这种关系的是( )
选项 | 甲 | 乙 | 丙 | 丁 |
A | 化合物 | 盐酸 | MnO2 | 铁粉 |
B | 合成材料 | 合金 | 合成纤维 | 合成橡胶 |
C | 化学变化 | 置换反应 | 化合反应 | 复分解反应 |
D | 放热反应 | 硫在空气中燃烧 | NaOH溶液与稀H2SO4反应 | 高温分解石灰石 |
A.AB.BC.CD.D