题目内容
某一铜与铁的混合物,分成质量相等的两份,一份加足量稀硫酸,反应完毕后,有6.5g不溶物;另一份加足量硫酸铜溶液,最后得沉淀物12.9g.求原混合物中铜的质量分数是多少?
【答案】分析:因为Cu的金属活动性在(H)之后,不能与稀硫酸发生置换反应,也不能与硫酸铜反应,混合物中只有铁可与稀硫酸和硫酸铜反应;
根据“一份加足量稀硫酸,反应完毕后,有6.5g不溶物”可知,一份混合物中铜的质量为6.5g;“另一份加足量硫酸铜溶液,最后得沉淀物12.9g”,其中的沉淀物为Cu(包含置换出的铜和混合物中的铜),据此计算出铁与硫酸铜反应置换出铜的质量,然后利用此化学方程式和生成的铜的质量,就可计算出一份混合物中铁的质量;然后根据质量分数公式计算即可.
解答:解:根据题意得,铁与硫酸铜反应置换出铜的质量为:12.9g-6.5g=6.4g,
设与硫酸铜完全反应的铁的质量为x,
Fe+CuSO4=FeSO4+Cu
56 64
x 6.4g
∴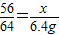 ,
,
解之得:x=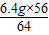 =5.6g,
=5.6g,
则原混合物中铜的质量分数为: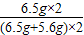 ×100%≈53.7%.
×100%≈53.7%.
答:原混合物中铜的质量分数为53.7%.
点评:本题主要考查学生利用化学方程式进行计算的能力.解答时要先弄清Cu不能与稀硫酸和硫酸铜反应,只有铁可与稀硫酸和硫酸铜反应.
根据“一份加足量稀硫酸,反应完毕后,有6.5g不溶物”可知,一份混合物中铜的质量为6.5g;“另一份加足量硫酸铜溶液,最后得沉淀物12.9g”,其中的沉淀物为Cu(包含置换出的铜和混合物中的铜),据此计算出铁与硫酸铜反应置换出铜的质量,然后利用此化学方程式和生成的铜的质量,就可计算出一份混合物中铁的质量;然后根据质量分数公式计算即可.
解答:解:根据题意得,铁与硫酸铜反应置换出铜的质量为:12.9g-6.5g=6.4g,
设与硫酸铜完全反应的铁的质量为x,
Fe+CuSO4=FeSO4+Cu
56 64
x 6.4g
∴
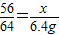 ,
,解之得:x=
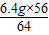 =5.6g,
=5.6g,则原混合物中铜的质量分数为:
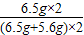 ×100%≈53.7%.
×100%≈53.7%.答:原混合物中铜的质量分数为53.7%.
点评:本题主要考查学生利用化学方程式进行计算的能力.解答时要先弄清Cu不能与稀硫酸和硫酸铜反应,只有铁可与稀硫酸和硫酸铜反应.

练习册系列答案
相关题目