题目内容
某一铜与铁的混合物,分成质量相等的两份,一份加足量稀硫酸,反应完毕后,有6.5 g不溶物,另一份加足量硫酸铜溶液,最后得沉淀物12.9 g。求原混合物中铜的质量分数是多少?
【答案】
53.7%
【解析】本题考查的是根据化学反应方程式的计算。解答时可根据金属活动性顺序分析:因为Cu的金属活动性在氢之后,故不能与稀硫酸发生置换反应,也不能与硫酸铜反应,混合物中只有铁可与稀硫酸和硫酸铜反应,再根据“一份加足量稀硫酸,反应完毕后,有6.5g不溶物”可知,一份混合物中铜的质量为6.5g,而“另一份加足量硫酸铜溶液,最后得沉淀物12.9g”,则其中的沉淀物为Cu(包含置换出的铜和原混合物中的铜),据此计算出铁与硫酸铜反应置换出铜的质量12.9g-6.5g=6.4g,然后利用此化学方程式和生成的铜的质量,就可计算出另一份混合物中铁的质量,然后根据质量分数公式计算即可。
设与硫酸铜完全反应的铁的质量为x,
Fe+CuSO4=FeSO4+Cu
56 64
x 6.4g
∴56:64 =x:6.4g
解之得:x=5.6g,
则原混合物中铜的质量分数为: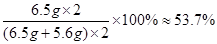
答:原混合物中铜的质量分数为53.7%。
点评:本题主要考查学生利用化学方程式进行计算的能力,解答时要弄清Cu不能与稀硫酸和硫酸铜反应,只有铁可与稀硫酸和硫酸铜反应。

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目