题目内容
【题目】如何将粗盐中的难溶性杂质(主要是泥沙)和可溶性杂质(主要是氯化镁、氯化钙)除去,从而得到较为纯净的食盐晶体?
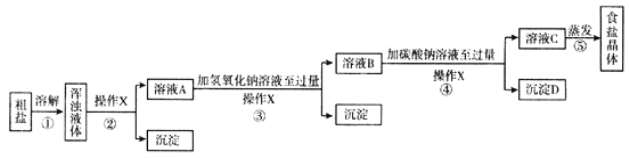
【实验方案】某同学为了提纯粗盐,设计了以上实验方案并进行实验
【交流与表达】
(1)实验操作X的名称是 ,该操作中要用到的玻璃仪器有烧杯、玻璃棒和 ;
(2)实验步骤③的主要目的是 (用化学方程式回答);判断氢氧化钠溶液已过量的方法是 ;
(3)实验④中生成的沉淀D是 (填化学式);
【反思与评价】
(4)有同学认为原实验方案不完善,做出这种评价的依据是 ;
【实验方案再设计】
(5)为了完善原实验方案,你设计的实验是 (仅写出补充部分的实验操作和现象)
【答案】(1)过滤 漏斗(2)MgCl2+2NaOH=Mg(OH)2↓+2NaCl;取少量溶液B,滴加酚酞试液,溶液变成红
色(3)碳酸钙(或CaCO3)(4) 有同学认为原实验方案不完善,做出这种评价的依据是因为加入的氢氧化钠和碳酸钠都是过量的,所以溶液中会残留着二者,因此最后得到的氯化钠也不是纯净的;(5) 在操作④中加入盐酸,至恰好没有气泡冒出后就停止加入。
【解析】
试题分析:实验操作X的名称是过滤目的是除去粗盐中的难溶性杂质;该操作中要用到的玻璃仪器有烧杯、玻璃棒和漏斗;实验步骤③的主要目的是除掉氯化镁;判断氢氧化钠是否过量的方法是取少量溶液B,滴加酚酞试液,溶液变成红色;实验④中生成的沉淀D是碳酸钙,因为碳酸钠和氢氧化钙反应会产生碳酸钙沉淀;因为加入的氢氧化钠和碳酸钠都是过量的,所以溶液中会残留着二者,因此最后得到的氯化钠也不是纯净的;因为氢氧化钠和碳酸钠都会和盐酸反应,而且氢氧化钠会首先和盐酸反应,因此在操作④中加入盐酸,如果恰好没有气泡冒出后就停止加入,二者就会被完全转化为氯化钠。

练习册系列答案
相关题目