题目内容
【题目】某化学兴趣小组为测定当地的石灰石中碳酸钙的质量分数,在实验室用10克石灰石样品(杂质不参加反应)与30克稀盐酸恰好完全反应,测得残留物为36.7克。求:
(1)生成二氧化碳的质量为 克;
(2)该样品中碳酸钙的质量分数(请写出解题过程)。
【答案】(1) 3.3(2)75﹪。
【解析】
试题分析:根据质量守恒定律知道生成二氧化碳的质量为=10克+30克-36.7克=3.3克
设该样品中碳酸钙的质量为X。
CaCO3 + 2HCl==CaCl2 + CO2↑ + H2O
100 44
X 3.3克
列比例式得:100:X=44:3.3克 解得X=7.5克 该样品中碳酸钙的质量分数=7.5克/10克×100%=75%。

练习册系列答案
相关题目
【题目】如图所示,某河旁甲、乙、丙、丁四座化工厂排放的工业废水中分别含有碳酸钠、氯化铜、氢氧化钠、盐酸中的一种。某同学对1、2、3、4处水质监测时记录了以下现象。
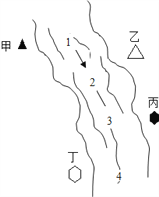
1 | 2 | 3 | 4 | |
记录现象 | 无色溶液 | 蓝色浑浊 | 浑浊消失 | 产生气泡 |
请回答下列相关问题:
(1)根据现象推断,甲、乙、丙、丁四座化工厂排放工业废水的成分,错误的是(________)
A.甲:碳酸钠 B.乙:氯化铜 C.丙:盐酸 D.丁:氢氧化钠
(2)若要检验甲厂排出的废水的酸碱性,可以选择的试剂是____________;
(3)2、3两处的化学方程式_______________________、_______________________。

