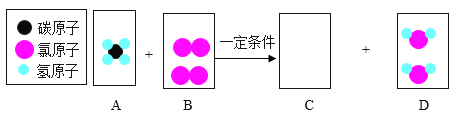
题目内容
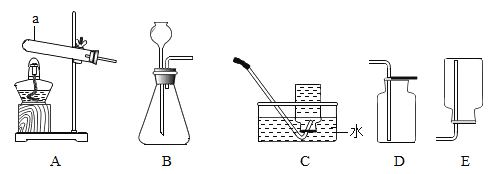
【题目】某兴趣小组对KClO3分解反应的催化剂进行研究,在相同的加热条件下,用下图装置完成表中实验。
编号 | KClO3质量/g | 催化剂 | 催化剂质量/g | 收集50mLO2所需时间/s |
实验1 | 5 | - | - | 171 |
实验2 | 5 | MnO2 | 0.5 | 49 |
实验3 | 5 | Fe2O3 | 0.5 | 58 |
实验4 | 5 | KCl | 0.5 | 154 |
(1)仪器①的名称为____________。
(2)实验室用KClO3制取氧气的化学方程式为_______________________________。
(3)表中所列3种催化剂的催化效果最佳的是____________。
(4)由实验1和实验4可知,KCl对KClO3分解______(填“有”或“无”)催化作用。
(5)要比较KClO3分解反应中不同催化剂的催化效果,除了测量收集50mLO2所需时间外,还可以测量相同时间内____________。
【答案】酒精灯 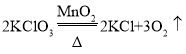 MnO2 有 收集气体的体积
MnO2 有 收集气体的体积
【解析】
(1)装置图中仪器①的名称为:酒精灯。
(2)实验室常用氯酸钾和二氧化锰的混合物制取氧气,氯酸钾在二氧化锰的催化作用和加热条件下反应生成氯化钾和氧气,故实验室用KClO3制取氧气的化学方程式为: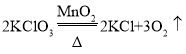 。
。
(3)表中所列3种催化剂,实验中收集50mLO2所需时间,MnO2作催化剂的用时最少,只有49s,所以催化效果最佳的是:MnO2。
(4)由实验1和实验4对比可知,收集50mLO2所需时间,加入KCl比没有加入氯化钾所用时间少,故KCl对KClO3分解有催化作用。
(5)要比较KClO3分解反应中不同催化剂的催化效果,可以采用测量收集相同体积气体所需时间的方法,也可以采用测量在相同时间内产生气体体积的方法。故除了可以采用测量收集50mLO2所需时间的方法外,还可以采用测量相同时间内收集气体体积的方法。

 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案【题目】氧气是我们身边无法离开的物质,某兴趣小组对氧气的研究如下:
Ⅰ.氧气的制备:
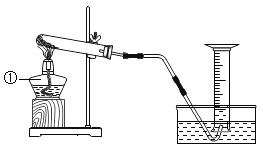
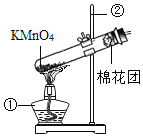
(1)写出如图中有标号仪器的名称:①_____。
(2)该装置中棉花团的作用是_____,图中装置一处明显的错误是_____。
Ⅱ.氧气的收集:
[实验1]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃时停止收集,测定瓶中氧气的含量,重复实验3次。
[实验2]用向上排空气法收集氧气,当放置在集气瓶口带火星木条复燃后,继续收集40秒,测定瓶中氧气的含量,重复实验3次。
[实验3]用排水法收集氧气,测定瓶中氧气的含量,重复实验3次。
实验数据:
实验1 | 实验2 | 实验3 | |||||||
氧气的体积分数(%) | 79.7 | 79.6 | 79.9 | 88.4 | 89.0 | 87.9 | 90.0 | 89.8 | 89.3 |
氧气的平均体积分数(%) | 79.7 | 88.4 | 89.7 | ||||||
数据
(3)三个实验均需重复3次的目的是_____。由实验1、2可知,用向上排空气法收集氧气时,为提高获得的氧气体积分数,可采取的措施是_____。
(4)不考虑操作因素,实验3获得的氧气体积分数不能达到100%的主要原因是_____。
Ⅲ.铁丝在氧气中燃烧
(5)铁丝在纯净氧气中燃烧的化学方程式为_____。
(6)铁丝(含碳颗粒)燃烧时火星四射,经研究表明产生火星四射现象的原因,可能是同时生成了某种气体,推测该气体是_____(填化学式)。
【题目】某化学兴趣小组为探究金属铝和铜的活动性强弱,开展了以下活动。
[查阅资料]经查阅,金属铝在常温下能与空气中的氧气反应生成致密的氧化铝薄膜。该反应的化学方程式为_________________。
[对比实验]
编号 | 操作 | 现象 |
甲 | 将表面未打磨的铝丝浸入CuSO4溶液中 | 无明显现象 |
乙 | 将表面打磨后的铝丝浸入CuSO4溶液中 | 铝丝表面析出红色固体 |
丙 | 将表面未打磨的铝丝浸入CuCl2溶液中 | 铝丝表面析出红色固体 |
(1)比较实验乙和实验_______________(填“甲”或“丙”)可得知:打磨能破坏氧化铝薄膜。
(2)小明同学对实验丙的现象进行分析,认为H2O对氧化铝薄膜有破坏作用。但此观点马上被其他同学否定,否定的依据是____________________。
[猜测与探究]
小组同学针对实验丙的现象,经讨论后猜测:Cl-破坏了氧化铝薄膜。
为检验此猜测是否正确,他们首先向两支试管中加入相同的CuSO4溶液,并均浸入表面未打磨的铝丝,然后进行了新的探究:
操作 | 现象 | 结论 | 推论 |
(1)向一支试管中再加入NaCl固体 | 铝丝表面析出红色固体 | 氧化铝薄膜被破坏 | Na+或___________能破坏氧化铝薄膜 |
(2)向另一支试管中再加入Na2SO4固体 | ___ | 氧化铝薄膜未被破坏 | Na+和SO42-都不能破坏氧化铝薄膜 |
[结论与反思]得出结论:前述猜测___(填“正确”或“不正确”)
[拓展应用]家庭里的铝制品在使用时要避免与______________接触(填一种即可)
总结反思:本次探究充分运用了比较法和控制变量法
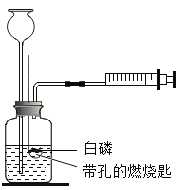
【题目】已知白磷的着火点为40℃,某兴趣小组探究可燃物的燃烧条件,实验装置图和实验步骤如下表:(实验过程中长颈漏斗下端始终在液面以下:注射器的摩擦力忽略不计)
实验步骤 | 实验现象 |
①将白磷放在燃烧匙内,塞好胶塞 | |
②从长颈漏斗向瓶内迅速注入60℃的水至刚刚浸没白磷 | 白磷没有燃烧 |
③连接好注射器,向瓶内推入空气,瓶内水面下降,停止推入空气 | 白磷燃烧,有白烟产生 |
④白磷熄灭后,冷却至室温,瓶内水面上升,最后淹没白磷 |
(1) 实验前需要检查装置的气密性,请写出检查该装置气密性的方法________。
(2) 请写出白磷燃烧的化学方程式___________________。
(3) 对比步骤②和③可知,可燃物燃烧的条件之一是___________,若把60℃的水换成20℃水,重复以上实验步骤,还可以得出物质燃烧需要的条件是________
(4) 步骤④中瓶内水面上升的原因是_____。