题目内容
同学们在学习碱的化学性质时,进行了如下图所示的实验。
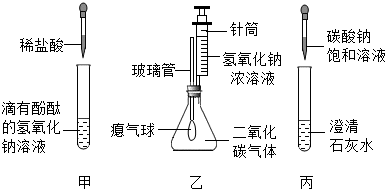
(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称)。
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠;小红认为:只有氢氧化钙;小林认为:是氢氧化钠和碳酸钠
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
【反思拓展】在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑 。

(1)写出甲实验中盐酸和氢氧化钠反应的化学方程式 。
(2)乙实验中滴加氢氧化钠溶液后,可观察到的现象是 。
(3)丙实验中观察到试管内有白色沉淀产生。
(4)实验结束后,同学们将甲、乙、丙三个实验的废液倒入同一个干净的废液缸中,最终看到废液浑浊并呈红色,产生疑问。
【提出问题】废液中含有哪些物质?
【交流讨论】①一定含有的物质:碳酸钙、指示剂、水和 (写物质名称)。
②还含有能使废液呈碱性的物质.能使废液呈碱性的物质是什么?同学们有如下猜想。
小云认为:只有碳酸钠;小红认为:只有氢氧化钙;小林认为:是氢氧化钠和碳酸钠
【实验设计】小方想用氯化钙溶液来验证小云、小红、小林的猜想。查阅资料获悉氯化钙溶液呈中性,并设计如下实验。请你将小方的实验设计补充完整。
| 实验内容 | 预计现象 | 预计结论 |
| 取少量废液缸中上层清液于试管中,加入过量氯化钙溶液,静置。 | ①有白色沉淀,溶液呈红色。 | 小林的猜想正确。 |
| ② 。 | 小云的猜想正确。 | |
| ③没有白色沉淀,溶液呈红色。 | 小红的猜想正确。 |
(1)HCl+NaOH==NaCl+H2O;(2)气球胀大;(4)氯化钠;
有白色沉淀生成,溶液由红色变成无色;反应物过剩。
有白色沉淀生成,溶液由红色变成无色;反应物过剩。
试题分析:(1)酸与碱会发生中和反应,故盐酸与氢氧化钠反应生成的的是氯化钠和水:HCl+NaOH==NaCl+H2O;
(2)由于氢氧化钠会与二氧化碳反应生成碳酸钠和水,导致锥形瓶内压强减小,故气球会变大;
(4)废液中一定有实验1中反应生成的氯化钠;由于氯化钙会与碳酸钠反应生成碳酸钙沉淀和氯化钠,氯化钠呈中性,故出现现象①表示小林的猜想正确;若只有碳酸钠,那么溶液仍为无色;若没有白色沉淀,溶液呈红色,说明只有氢氧化钙。故在在分析化学反应后所得物质的成分时,除了考虑生成物外还需考虑反应物是否过量。

练习册系列答案
相关题目