题目内容
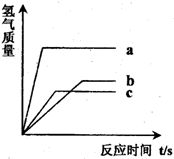
 等质量的三种金属分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列有关说法正确的是(金属不是K、Na、Ca)( )
等质量的三种金属分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列有关说法正确的是(金属不是K、Na、Ca)( )分析:由产生氢气的体积与反应时间的关系图,等质量的a最先完成反应而b最后反应完成;完全反应后a放出氢气量最大而c最小,据此依据金属活动性顺序的意义以及相关质量的关系分析判断即可;
解答:解:A、等质量的a、b、c三种金属,a最先完成反应,其次为c,而b最后反应完全,依据金属活动性顺序的意义可判断三种金属的活动性大小为a>c>b;故A不正确;
B、由于相同质量的金属完全反应生成的氢气量关系是a>b>c,所以生成相同质量的氢气消耗金属的质量关系应该是c>b>a;故B不正确;
C、根据一定量金属完全反应产生氢气质量=
×金属的质量,因此金属的质量及化合价均相同,所以金属的相对原子质量与反应放出氢气的多少成反应比,则三种金属的相对原子质量是c>b>a;故C正确;
D、反应所放出氢气质量全部来自于稀盐酸,由于所放出氢气的质量不同,因此所消耗盐酸的质量一定不相同,生成氢气多的消耗盐酸的质量就多,所以消耗盐酸最多的是金属a;故D不正确;
故选C.
B、由于相同质量的金属完全反应生成的氢气量关系是a>b>c,所以生成相同质量的氢气消耗金属的质量关系应该是c>b>a;故B不正确;
C、根据一定量金属完全反应产生氢气质量=
| 金属化合价 |
| 金属的相对原子质量 |
D、反应所放出氢气质量全部来自于稀盐酸,由于所放出氢气的质量不同,因此所消耗盐酸的质量一定不相同,生成氢气多的消耗盐酸的质量就多,所以消耗盐酸最多的是金属a;故D不正确;
故选C.
点评:金属活动性越强,金属与酸反应越剧烈,在相同时间放则放出氢气的量越多,即反应速率越快.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
 (2012?奉贤区二模)等质量的三种金属分别跟足量的盐酸反应时均生成了相同化合价的盐酸盐,其反应情况如图所示,下列结论中正确的是( )
(2012?奉贤区二模)等质量的三种金属分别跟足量的盐酸反应时均生成了相同化合价的盐酸盐,其反应情况如图所示,下列结论中正确的是( )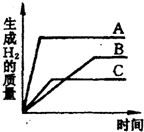 等质量的三种金属分别和足量的盐酸反应,均生成相应的盐酸盐(生成的盐中金属均显+2价),其反应情况如图.下列结论正确的是( )
等质量的三种金属分别和足量的盐酸反应,均生成相应的盐酸盐(生成的盐中金属均显+2价),其反应情况如图.下列结论正确的是( )