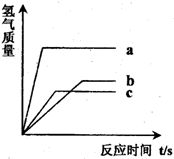
题目内容
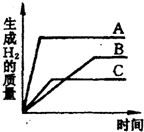 等质量的三种金属分别和足量的盐酸反应,均生成相应的盐酸盐(生成的盐中金属均显+2价),其反应情况如图.下列结论正确的是( )
等质量的三种金属分别和足量的盐酸反应,均生成相应的盐酸盐(生成的盐中金属均显+2价),其反应情况如图.下列结论正确的是( )分析:依据“足量稀盐酸”,等质量的三种金属完全反应,放出氢气的质量=
×金属质量,以及根据相同质量的金属与酸反应用的时间最短的金属活动性最强,时间最长的活动性最弱判断金属活动性强弱分析解答;
| 金属的化合价 |
| 金属的相对原子质量 |
解答:解:根据反应生成氢气的质量与反应时间的关系图所示,反应结束后用的时间最短的金属活动性最强,时间最长的活动性最弱,所以由图知,金属活动性A>C>B,故A正确D不正确;三种金属的质量相等、化合价也相同,则产生氢气质量与相对原子质量成反比,所以完全反应后A放出氢气质量最大,其相对原子质量最小;C产生氢气质量最小,相对原子质量最大;所以金属的相对原子质量为:C>A>B,故C都错误;
故选AB
故选AB
点评:对于活泼金属,活动性越强的金属与酸反应越剧烈,即反应放出氢气的速度越快;化合价相同的等质量金属完全反应放出氢气的质量与金属的相对原子质量成反比.

练习册系列答案
 口算心算速算应用题系列答案
口算心算速算应用题系列答案 同步拓展阅读系列答案
同步拓展阅读系列答案
相关题目
 (2012?奉贤区二模)等质量的三种金属分别跟足量的盐酸反应时均生成了相同化合价的盐酸盐,其反应情况如图所示,下列结论中正确的是( )
(2012?奉贤区二模)等质量的三种金属分别跟足量的盐酸反应时均生成了相同化合价的盐酸盐,其反应情况如图所示,下列结论中正确的是( ) 等质量的三种金属分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列有关说法正确的是(金属不是K、Na、Ca)( )
等质量的三种金属分别与足量的盐酸反应,产生氢气的质量与反应时间的关系如图所示,下列有关说法正确的是(金属不是K、Na、Ca)( )