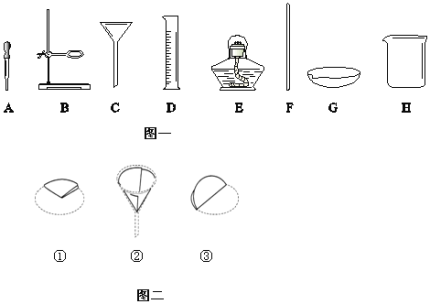
题目内容
【题目】某化学课外活动小组的同学为了测定某氮化镁样品中Mg3N2的质量分数,他们取氮化镁样品5.0g于烧杯中,加入100g某浓度的盐酸(足量),充分反应后(杂质不溶于水也不与盐酸反应),测得剩余固体的质量为1.0g。请计算:
(1)已知:Mg3N2与盐酸反应的生成物只有氯化镁和氯化铵,则在配平的该化学反应方程式中,HCl前面的化学计量数为________。
(2)氮化镁样品中Mg3N2的质量分数_____。(写出计算过程)
(3)此时所得溶液中氯化镁的质量分数_______。(写出计算过程)
【答案】8 80% 11%
【解析】
(1) Mg3N2与盐酸反应的生成物只有氯化镁和氯化铵,对应的化学方程式为Mg3N2+8HCl=2NH4Cl+3MgCl2。HCl前面的化学计量数为8;
(2))剩余固体为1.0g,所以氮化镁的质量=5.0g﹣1.0g=4.0g,氮化镁样品中Mg3N2的质量分数=![]() ;
;
(3)设:生成的氯化镁的质量为x。

![]() x=11.4g
x=11.4g
此时所得溶液中氯化镁的质量分数为![]() 。
。
答:(1)在配平的该化学反应方程式中,HCl前面的化学计量数为 8。
(2)氮化镁样品中Mg3N2的质量分数为80%。
(3)此时所得溶液中氯化镁的质量分数为11%。

练习册系列答案
 科学实验活动册系列答案
科学实验活动册系列答案
相关题目