题目内容
【题目】用98%的浓硫酸配制500g10%的稀硫酸
(1)主要实验步骤为:计算、_____________ 、稀释、装瓶贴签。
(2)现提供下列仪器,配制过程中需用到的仪器有_____________(填序号)
①量筒 ②托盘天平 ③试管 ④烧杯 ⑤滴管 ⑥玻璃棒
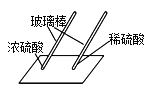
(3)某同学用玻璃棒分别蘸取浓硫酸和稀硫酸在白纸上写字(如下图),观察到浓硫酸能使白纸变黑,而稀硫酸不能。据此分析:由于二者的______________不同,因此性质不完全相同。
(4)现取4g废铁屑与49g10%的稀硫酸恰好完全反应(废铁屑中杂质不反应,也不溶水)。计算:
①废铁屑中铁的质量____________;
②反应后所得溶液中溶质的质量分数____________。(精确到0.1)
【答案】 量取 ①④⑤⑥ 浓度(或质量分数,合理即可) 2.8g 14.7%
【解析】(1)主要实验步骤为:计算、量取 、稀释、装瓶贴签;(2)配制过程中需用到的仪器有①量筒 ④烧杯 ⑤滴管 ⑥玻璃棒;(3)某同学用玻璃棒分别蘸取浓硫酸和稀硫酸在白纸上写字(如下图),观察到浓硫酸能使白纸变黑,而稀硫酸不能。据此分析:由于二者的浓度不同,浓硫酸有脱水性,能使纸变黑,稀硫酸不能;(4)硫酸的质量:49g×10%=4.9g,设①废铁屑中铁的质量为x;②反应后所得溶液中溶质的质量为y,生成氢气质量为z
Fe+ H2SO4 == FeSO4 + H2↑
56 98 152 2
X 4.9g y z
56/x=98/4.9g x=2.8g
152/y=98/4.9g y=7.6g
2/z=98/4.9g z=0.1g
反应后所得溶液中溶质的质量分数: 7.6g÷(2.8g+49g-0.1g)×100%=≈14.7%
答:①废铁屑中铁的质量2.8g;②反应后所得溶液中溶质的质量分数14.7%。

【题目】分析处理图表的信息是学习化学的一种重要方法。下表是氯化钠和碳酸钠在不同温度时的溶解度,根据此表回答:
温度/℃ | 10 | 20 | 30 | 40 | |
溶解度/g | 氯化钠 | 35.8 | 36.0 | 36.3 | 36.6 |
碳酸钠 | 12.2 | 21.8 | 39.7 | 53.2 | |
(1)40 ℃时,氯化钠的溶解度为________g。
(2)碳酸钠的溶解度随温度的升高而________(填“增大”或“减小”)。在20 ℃时,在100 g的水中加入30 g碳酸钠,充分搅拌后得到的是________(填“饱和溶液”或“不饱和溶液”),将上述溶液升温到30 ℃,该溶液的溶质质量分数为________(计算结果精确到0.1%)。
(3)10 ℃时,分别配制表中两种物质的饱和溶液,其中溶质质量分数较小的物质是________________________________________________________________________。