题目内容
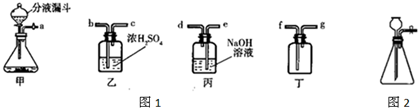
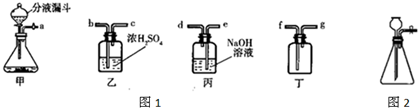
在实验室中可用如图1装置来制取气体,甲是常用的气体发生装置,通过分液漏斗可以向锥形瓶中滴加液体.请回答下列问题:
(1)实验室确定气体发生装置时应考虑的因素是______.
(2)制取氧气时,在装置甲的锥形瓶中放入二氧化锰,在分液漏斗中应加入的是______,该反应的化学方程式为______ 2H2O+O2↑
【答案】分析:(1)发生装置的选择依据反应物的状态和反应条件;
(2)根据发生装置的特征适合用过氧化氢溶液和二氧化锰制取氧气;
(3)干燥氧气可以用浓硫酸;
(4)检验二氧化碳用澄清的石灰水,看是否变浑浊;
(5)检查该装置气密性的方法是:将止水夹加上,再向长颈漏斗内注入水,看长颈漏斗内液面是否下降;
(6)根据物质的质量差,得出二氧化碳的质量;然后根据二氧化碳的质量计算出溶质氯化氢的质量,从而计算出溶质的质量分数.
解答:解:(1)实验室确定气体发生装置时应考虑的因素是反应物的状态和反应条件;
(2)该发生装置的特征适合用过氧化氢溶液和二氧化锰制取氧气,故锥形瓶内放入的是过氧化氢溶液;反应的方程式为:2H2O2 2H2O+O2↑;
2H2O+O2↑;
(3)用浓硫酸干燥氧气,用向上排空气法收集干燥的氧气;干燥时气体应该是“长进短出”,故装置的正确连接顺序是:a、b、c、f;
(4)检验二氧化碳用澄清的石灰水,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)将止水夹加上,再向长颈漏斗内注入水,若在长颈漏斗内液面不下降形成一段水柱,说明装置的气密性良好;
(6)解:设稀盐酸中氯化氢的质量为X,由题意可知,反应后生产二氧化碳12g+100g-107.6g═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
X 4.4g
 =
= X=7.3 g
X=7.3 g
稀盐酸中溶质的质量分数=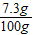 ×100%=7.3%
×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%.
故答案为:(1)反应物的状态和反应条件;(2)过氧化氢溶液;2H2O2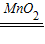 2H2O+O2↑;(3)a、b、c、f;
2H2O+O2↑;(3)a、b、c、f;
(4)CO2+Ca(OH)2=CaCO3↓+H2O;(5)将止水夹加上,再向长颈漏斗内注入水,若长颈漏斗内液面不下降,说明装置不漏气;
(6)解:设稀盐酸中氯化氢的质量为X,由题意可知,反应后生产二氧化碳12g+100g-107.6g═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
X 4.4g
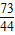 =
=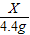 X=7.3 g
X=7.3 g
稀盐酸中溶质的质量分数=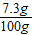 ×100%=7.3%
×100%=7.3%
答:稀盐酸中溶质的质量分数为7.3%.
点评:本题考查了气体的制取、装置气密性的检验及根据化学方程式进行计算,考查比较全面,关键要理解题意结合已有的知识进行解决.
(2)根据发生装置的特征适合用过氧化氢溶液和二氧化锰制取氧气;
(3)干燥氧气可以用浓硫酸;
(4)检验二氧化碳用澄清的石灰水,看是否变浑浊;
(5)检查该装置气密性的方法是:将止水夹加上,再向长颈漏斗内注入水,看长颈漏斗内液面是否下降;
(6)根据物质的质量差,得出二氧化碳的质量;然后根据二氧化碳的质量计算出溶质氯化氢的质量,从而计算出溶质的质量分数.
解答:解:(1)实验室确定气体发生装置时应考虑的因素是反应物的状态和反应条件;
(2)该发生装置的特征适合用过氧化氢溶液和二氧化锰制取氧气,故锥形瓶内放入的是过氧化氢溶液;反应的方程式为:2H2O2
 2H2O+O2↑;
2H2O+O2↑;(3)用浓硫酸干燥氧气,用向上排空气法收集干燥的氧气;干燥时气体应该是“长进短出”,故装置的正确连接顺序是:a、b、c、f;
(4)检验二氧化碳用澄清的石灰水,反应的方程式为:CO2+Ca(OH)2=CaCO3↓+H2O;
(5)将止水夹加上,再向长颈漏斗内注入水,若在长颈漏斗内液面不下降形成一段水柱,说明装置的气密性良好;
(6)解:设稀盐酸中氯化氢的质量为X,由题意可知,反应后生产二氧化碳12g+100g-107.6g═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
X 4.4g
 =
= X=7.3 g
X=7.3 g稀盐酸中溶质的质量分数=
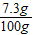 ×100%=7.3%
×100%=7.3%答:稀盐酸中溶质的质量分数为7.3%.
故答案为:(1)反应物的状态和反应条件;(2)过氧化氢溶液;2H2O2
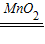 2H2O+O2↑;(3)a、b、c、f;
2H2O+O2↑;(3)a、b、c、f;(4)CO2+Ca(OH)2=CaCO3↓+H2O;(5)将止水夹加上,再向长颈漏斗内注入水,若长颈漏斗内液面不下降,说明装置不漏气;
(6)解:设稀盐酸中氯化氢的质量为X,由题意可知,反应后生产二氧化碳12g+100g-107.6g═4.4g
CaCO3+2HCl═CaCl2+H2O+CO2↑
73 44
X 4.4g
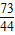 =
=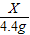 X=7.3 g
X=7.3 g稀盐酸中溶质的质量分数=
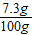 ×100%=7.3%
×100%=7.3%答:稀盐酸中溶质的质量分数为7.3%.
点评:本题考查了气体的制取、装置气密性的检验及根据化学方程式进行计算,考查比较全面,关键要理解题意结合已有的知识进行解决.

练习册系列答案
相关题目
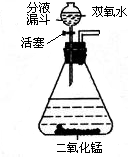
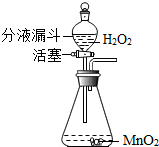 (2006?荆门)过氧化氢(化学式为H2O2)俗称双氧水,常温下是一种无色液体,它在MnO2作用下能迅速分解放出氧气,同时生成水.在实验室中可用如图所示装置用双氧水制取氧气(通过分液漏斗玻璃活塞的“开”“关”,可随时向锥形瓶中滴加双氧水).
(2006?荆门)过氧化氢(化学式为H2O2)俗称双氧水,常温下是一种无色液体,它在MnO2作用下能迅速分解放出氧气,同时生成水.在实验室中可用如图所示装置用双氧水制取氧气(通过分液漏斗玻璃活塞的“开”“关”,可随时向锥形瓶中滴加双氧水).