题目内容
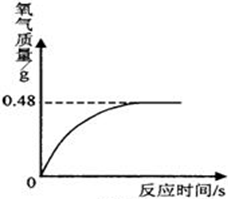
现有一定质量的氯酸钾和二氧化锰的混合物,加热使之完全反应,结果发现试管内固体物质的质量比原来减少了4.8g,此时残留固体的质量为10.2g.求:
(1)生成氧气的质量为多少?
(2)原固体中氯酸钾和二氧化锰的质量各是多少?
(1)生成氧气的质量为多少?
(2)原固体中氯酸钾和二氧化锰的质量各是多少?
分析:依据质量守恒定律可知固体减少的质量即为生成氧气的质量,依据氧气的质量可以求出氯化钾的质量,进而可以求出二氧化锰的质量;
解答:解:(1)依据质量守恒定律可知生成氧气的质量是4.8g;
(2)设生成氯化钾的质量是x
2KClO3
2KCl+3O2↑
149 96
x 4.8g
=
x=7.45g
则剩余固体中二氧化锰的质量是10.2g-7.45g=2.75g
依据催化剂的特点可知反应前二氧化锰的质量也是2.75g,由质量守恒定律可知原固体中氯酸钾的质量是2.75g+7.45g=10.2g
答:(1)生成氧气的质量为4.8g;(2)原固体中氯酸钾和二氧化锰的质量各是10.2g、2.75g;
(2)设生成氯化钾的质量是x
2KClO3
| ||
| △ |
149 96
x 4.8g
| 149 |
| x |
| 96 |
| 4.8g |
x=7.45g
则剩余固体中二氧化锰的质量是10.2g-7.45g=2.75g
依据催化剂的特点可知反应前二氧化锰的质量也是2.75g,由质量守恒定律可知原固体中氯酸钾的质量是2.75g+7.45g=10.2g
答:(1)生成氧气的质量为4.8g;(2)原固体中氯酸钾和二氧化锰的质量各是10.2g、2.75g;
点评:此题是利用化学方程式的简单计算,需注意催化剂反应前后质量不变,所以反应后的固体中肯定有二氧化锰.另外用质量守恒定律计算反应后生成气体是一种常用方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目