题目内容
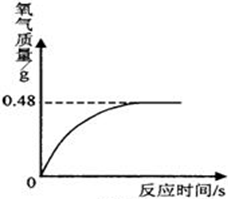
现有一定质量的氯酸钾和0.1g二氧化锰组成的混合物,将其加热制取氧气至刚好得到所需氧气量为止,此时,剩余固体为4.04g;再给这些固体加热至不再产生气体为止,又得到氧气为0.96g.求混合物中氯酸钾第一次分解的百分率.分析:二氧化锰是该反应的催化剂,反应前后质量不变,所以剩余固体中含有0.1g二氧化锰、反应生成的氯化钾、未反应的氯酸钾,根据0.96g氧气的质量可求出剩余固体中氯酸钾的质量,根据氯化钾的质量(用剩余固体的质量-二氧化锰的质量-未反应的氯酸钾的质量)可求出第一次分解的氯酸钾的质量,用
×100%即可求出混合物中氯酸钾第一次分解的百分率.
| 第一次分解的氯酸钾的质量 |
| 氯酸钾的总质量 |
解答:解:设剩余固体中氯酸钾的质量为x
2KC lO3
2KCl+3O2↑
245 96
x 0.96g
=
x=2.45g
第一次分解生成氯化钾的质量=4.04g-2.45g-0.1g=1.49g
设第一次分解的氯酸钾的质量为y
2KClO3
2KCl+3O2↑
245 149
y 1.49g
=
y=2.45g
混合物中氯酸钾第一次分解的百分率=
×100%=50%
答:混合物中氯酸钾第一次分解的百分率为50%.
2KC lO3
| ||||
| △ |
245 96
x 0.96g
| 245 |
| x |
| 96 |
| 0.96g |
x=2.45g
第一次分解生成氯化钾的质量=4.04g-2.45g-0.1g=1.49g
设第一次分解的氯酸钾的质量为y
2KClO3
| ||||
| △ |
245 149
y 1.49g
| 245 |
| y |
| 149 |
| 1,49g |
y=2.45g
混合物中氯酸钾第一次分解的百分率=
| 2.45g |
| 2.45g+2.45g |
答:混合物中氯酸钾第一次分解的百分率为50%.
点评:本道题比较难,解题关键是要分析清楚哪些量为已知量.二氧化锰是该反应的催化剂,反应前后质量不变,不能将二氧化锰的质量代入化学方程式进行计算.

练习册系列答案
相关题目