题目内容
 碘元素是人体必需的微量元素之一.
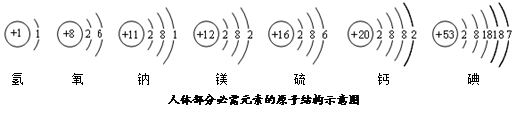
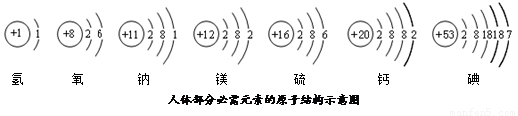
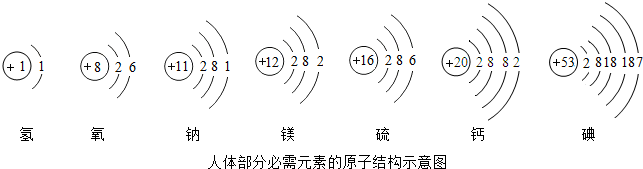
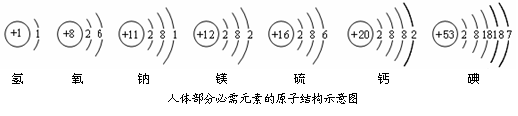
碘元素是人体必需的微量元素之一.(1)如图是元素周期表中碘元素的部分信息.碘原子的核电荷数是
53
53
,(2)已知某碘盐的主要成分为氯化钠和碘酸钾(KIO3):
①氯化钠的化学式
NaCl
NaCl
,含有的阴离子是Cl-
Cl-
(用符号表示),②KIO3中I的化合价为
+5价
+5价
.③已知每包碘盐中最多含碘元素15mg,则每包碘盐中最多含KIO3的质量为
15mg÷(
×100%)或15÷(
×100%)或约25.3 )
| 126.9 |
| 126.9+39+16×3 |
| 126.9 |
| 213.9 |
15mg÷(
×100%)或15÷(
×100%)或约25.3 )
mg(列出计算式即可,碘的相对原子质量从上图中查找).| 126.9 |
| 126.9+39+16×3 |
| 126.9 |
| 213.9 |
分析:(1)根据元素周期表中的一个小格所提供的信息,其中原子序数=核外电子数=质子数=核电荷数,进行解答;
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是Cl-;
②根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
③根据物质中某元素的质量=该物质的质量×该元素的质量分数,进行解答.
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是Cl-;
②根据“在化合物中,正负化合价的代数和为零”的原则,解答KIO3中I的化合价;
③根据物质中某元素的质量=该物质的质量×该元素的质量分数,进行解答.
解答:解:(1)根据元素周期表中的一个小格所提供的信息,可知碘原子的核电荷数是 53,
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是氯离子;表示为:Cl-;
②根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
(3)设每包碘盐中最多含KIO3的质量为y
15mg=y×
×100% 则y=15mg÷(
×100%)=25.3mg;
故答案为:(1)53;(2)①NaCl;Cl-;②+5价;
③15mg÷(
×100%)或15mg÷(
×100%)或约25.3mg )
(2)①氯化钠是由钠元素和氯元素组成的化合物,化学式为NaCl;氯化钠含有的阴离子是氯离子;表示为:Cl-;
②根据“在化合物中,正负化合价的代数和为零”的原则,可得KIO3中I的化合价为:(+1)+x+(-2)×3=0;x=+5;
(3)设每包碘盐中最多含KIO3的质量为y
15mg=y×
| 126.9 |
| 126.9+39+16×3 |
| 126.9 |
| 126.9+39+16×3 |
故答案为:(1)53;(2)①NaCl;Cl-;②+5价;
③15mg÷(
| 126.9 |
| 126.9+39+16×3 |
| 126.9 |
| 213.9 |
点评:本题考查学生对化合价计算及根据物质中某元素的质量及质量分数计算方法的掌握与在解题中应用的能力

练习册系列答案
相关题目

 依图填空:
依图填空: ▲ ;
▲ ;