题目内容
依图填空:
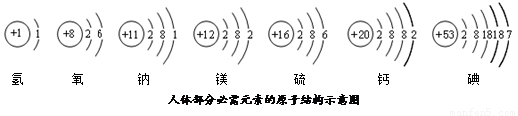
⑴硫离子的符号为 ,硫酸钠的化学式为 ;
⑵从原子结构上分析,图中钙、镁元素具有相似化学性质的主要原因是 ;
⑶生石灰(由图中某两种元素组成)常用作干燥剂,该干燥剂的吸水原理是 (用化学方程式表示);
⑷碘元素是人体必需的 (填“常量”或“微量”)元素,它处于元素周期表中的第
周期;由图中钙、碘、氧三种元素组成的碘酸钙[Ca(IO3)2]中,碘元素显 价。
⑴ S2- (1分) Na2SO4(1分)⑵ 它们原子核外的最外层电子数相同(1分)
⑶ CaO + H2O= Ca(OH)2(1分)⑷ 微量(1分) 五(或5)(1分) +5 (1分)
【解析】CaO + H2O= Ca(OH)2
试题分析:(1)由于硫原子最外层电子数为6,故在化学变化中容易得到2个电子,而形成8个电子的相对稳定结构,因此硫离子带2个单位的负电荷,故为S2-;硫酸钠是由钠离子和硫酸根离子构成的,故化学式为Na2SO4。
(2)原子核外最外层电子数与其化学性质关系密切,即最外层电子数相同,化学性质相似,由于钙、镁元素它们原子核外的最外层电子数相同,故具有相似的化学性质。
(3)生石灰常用作干燥剂,是因为生石灰能与水反应生成熟石灰,故反应的化学方程式为CaO + H2O= Ca(OH)2。
(4)碘元素是人体必需的微量元素,由于它的原子核外有5个电子层,故它处于元素周期表中的第5周期;在碘酸钙[Ca(IO3)2]中,已知Ca的化合价为+2价,O的化合价为-2价,可设I的化合价为x,则根据化合物中正负化合价的代数和为0的原则,得(+2)+[x+(-2)×3]×2=0,解得x=+5。
考点:化学符号及其周围数字的意义,化学式的书写,原子结构示意图与离子结构示意图,元素周期表的特点及其应用,有关元素化合价的计算
点评:本题难度不大,但涉及的知识点较多,且均属于对基础知识的考查,要求学生在平时的学习中要加强相关基础知识的储备。

 科学实验活动册系列答案
科学实验活动册系列答案
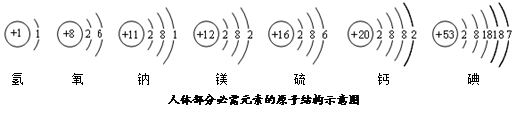
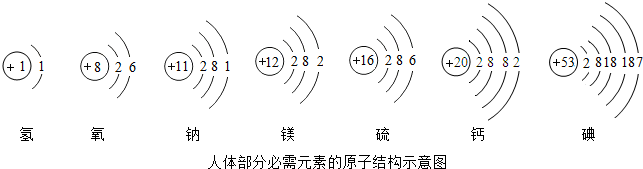
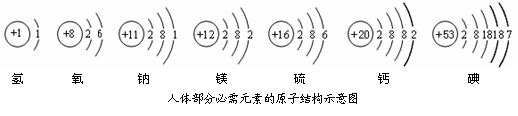 依图填空:
依图填空: ▲ ;
▲ ;