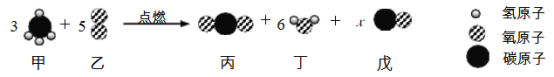题目内容
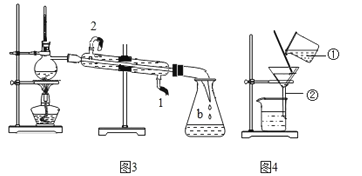
【题目】硅(Si)是半导体材料,利用石英砂(主要成分是 SiO2)制取高纯度 Si,其流程图如图:

下列说法正确的是( )
A. 反应①、③为置换反应
B. 反应①产生的尾气可直接排放
C. 该过程中各元素的化合价均发生了变化
D. 反应③为 SiHCl3+H2 ![]() Si+3M,M 可循环使用
Si+3M,M 可循环使用
【答案】AD
【解析】A. 由一种单质与一种化合物反应,生成另一种单质与另一种化合物的反应是置换反应。反应①是SiO2+2C![]() Si+2CO↑,根据质量守恒定律,反应③是SiHCl3+H2
Si+2CO↑,根据质量守恒定律,反应③是SiHCl3+H2 ![]() Si+3HCl,都属于置换反应,正确;B. 反应①产生的尾气是有毒的CO,直接排放会污染空气,错误;C. 该过程中部分元素的化合价发生了变化,错误;D. 反应③为SiHCl3+H2
Si+3HCl,都属于置换反应,正确;B. 反应①产生的尾气是有毒的CO,直接排放会污染空气,错误;C. 该过程中部分元素的化合价发生了变化,错误;D. 反应③为SiHCl3+H2 ![]() Si+3HCl,HCl可循环使用,正确。故选AD。
Si+3HCl,HCl可循环使用,正确。故选AD。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
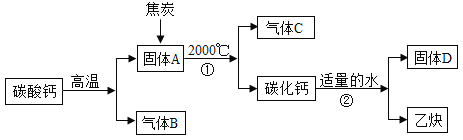
小学生10分钟应用题系列答案【题目】工业上生产电石(CaC2)并制备重要工业原料乙炔(CxHy)流程如下:
(资料)
(1)碳酸钙高温分解可得两种氧化物。
(2)浓硫酸具有强吸水性,NaOH 溶液能吸收 CO2。
(讨论)
(1)C、B 组成元素相同,C 有毒,反应①的化学方程式为______________________。
(2)D 微溶于水,溶解度随温度升高而减小,D 的化学式是___________________。
(测定乙炔组成) 资料:一个乙炔分子由四个原子构成。
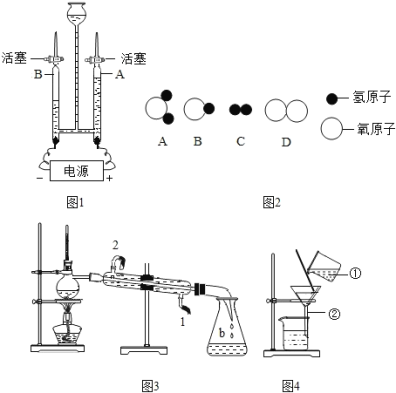
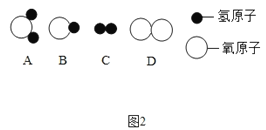
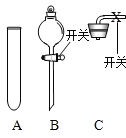
(3)将一定量的乙炔(CxHy)完全燃烧, 并将生成的气体缓缓通过如图的 _____________________________选填 “I”或“II”)装置,并再缓缓通入一段时间 的 N2,并记录实验数据于表中。
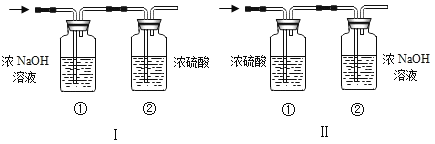
反应前质量/g | 反应后质量/g | |
装置① | 125.3 | 127.1 |
装置② | 78.2 | 87.0 |
(4)实验中“缓缓通入一段时间 N2”的目的是________。
(5)计算:乙炔中碳元素的质量为________g,氢元素 的质量为____________g,乙炔的化学式为________。
(6)反应②的化学方程式________。
【题目】在一个密闭容器内有X、Y、Z、Q四种物质,在一定条件下充分反应,测得反应前后各物质的质量如下:
物 质 | X | Y | Z | Q |
反应前质量/g | 4 | 10 | 1 | 25 |
反应后质量/g | 未测 | 21 | 10 | 9 |
下列说法错误的是
A.该反应为分解反应B.该反应中X与Q的质量比是1︰4
C.X中未测值为零D.若Q为氧气,则该反应为氧化反应