题目内容
【题目】根据如图所示,按要求回答问题
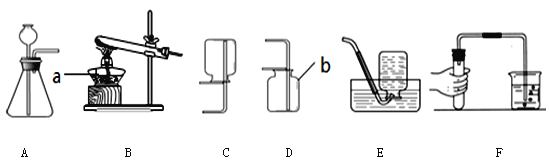
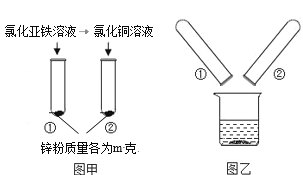
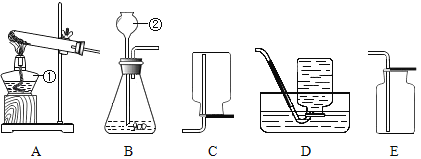
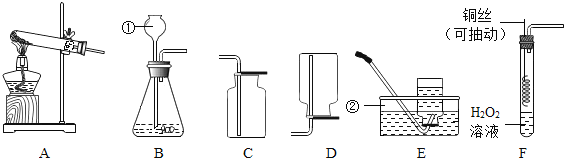
![]() 写出图中标号名称a______ b______;
写出图中标号名称a______ b______;
![]() 图F实验操作叫做______;
图F实验操作叫做______;
![]() 用大理石和稀盐酸反应制取二氧化碳气体,所选用的发生装置是______
用大理石和稀盐酸反应制取二氧化碳气体,所选用的发生装置是______![]() 填序号
填序号![]() ;收集装置是______;反应的化学方程式______;
;收集装置是______;反应的化学方程式______;
![]() 实验室常用氯化铵固体与碱石灰固体共热来制取氨气
实验室常用氯化铵固体与碱石灰固体共热来制取氨气![]() 。常温下
。常温下![]() 是一种无色、有刺激性气味的气体,密度比空气小。
是一种无色、有刺激性气味的气体,密度比空气小。![]() 极易溶于水,其水溶液呈碱性。制取并收集
极易溶于水,其水溶液呈碱性。制取并收集![]() ,应该从图中选择收集装置是______。
,应该从图中选择收集装置是______。
【答案】酒精灯 集气瓶 检查装置的气密性 A D ![]() C
C
【解析】
![]() 仪器a是酒精灯,b是集气瓶;故填:酒精灯;集气瓶;
仪器a是酒精灯,b是集气瓶;故填:酒精灯;集气瓶;
![]() 图F的实验操作是检查装置的气密性操作;故填:检查装置的气密性;
图F的实验操作是检查装置的气密性操作;故填:检查装置的气密性;
![]() 大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,该反应属于固液常温型,所以选择装置A来制取,二氧化碳的密度比空气大、能溶于水,所以可用向上排空气法收集;故填:A;D;
大理石的主要成分是碳酸钙,碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,该反应属于固液常温型,所以选择装置A来制取,二氧化碳的密度比空气大、能溶于水,所以可用向上排空气法收集;故填:A;D;![]() ;
;
![]() 常温下
常温下![]() 是一种无色、有刺激性气味的气体,密度比空气小。
是一种无色、有刺激性气味的气体,密度比空气小。![]() 极易溶于水,所以用向下排空气法来收集氨气;故填:C。
极易溶于水,所以用向下排空气法来收集氨气;故填:C。

 阅读快车系列答案
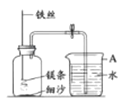
阅读快车系列答案【题目】某研究小组用下图所示装置,探究能否用镁条代替红磷测定空气中氧气含量。
实验前,小组成员提出了不同的猜想。
【猜想与假设】
猜想1:可以代替,因为镁条与氧气反应后不会产生气体
猜想2:不能代替,查阅资料知金属镁很活泼,可能会与空气中的氮气反应
【进行实验】
步骤 | 实验操作 | 实验现象 |
Ⅰ | 组装好装置后,打开止水夹,手捂集气瓶,一段时间后,松开手 | 烧杯中导管口有气泡冒出,松手后,烧杯中导管末端有一段液柱 |
Ⅱ | 关闭止水夹,点燃镁条,迅速伸入集气瓶中,塞好塞子 | 镁条燃烧,放出大量热,发出耀眼白光,生成大量白烟,剩余固体为白色带状物 |
Ⅲ | 冷却至室温,打开止水夹 | 烧杯中水从导管进入集气瓶中,体积约为集气瓶体积的2/5 |
【解释与结论】
(1)Mg与氧气反应的化学方程式为_________。
(2)步骤Ⅰ说明装置的气密性_________。
(3)步骤Ⅱ中,关闭止水夹的目的是_________。
(4)推测猜想2成立的现象证据是_________。
【反思与评价】
(5)该小组认为,即使步骤Ⅲ中水的体积恰好占集气瓶体积的1/5,也不能说明猜想1成立,理由是_________。
(6)小组中同学对镁条与瓶中气体的反应提出了进一步的猜想:甲同学认为镁条先与O2反应,乙同学认为镁条先与N2反应。为进一步检验他们的猜想,可以进行的实验操作是:取少量镁条,点燃后迅速放入盛有空气的集气瓶中,待镁条熄灭后,________。