题目内容
溶液在日常生活和工农业生产上有着广泛的应用.(1)硫酸钠溶液中,溶质是 ,溶剂是 .
(2)如图是氯化钠和硫酸钠两种物质的溶解度曲线.

①大约在 ℃时两种物质的溶解度相等;
②现将氯化钠和硫酸钠的混合物在40℃时溶解达饱和,然后降温至10℃,有晶体析出.则析出的晶体中主要成分是 ;
③在0℃-40℃温度范围内,硫酸钠溶解度随温度变化的趋势是 .
(3)下列实验操作的结果使溶液变混浊的是 [填序号]
A.向盛满CO2的集气瓶中倒入少量澄清的石灰水;
B.20℃时向盛有100g 26.5%的食盐水的试管中加入2g食盐,振荡;
C.一定温度下,向饱和的氯化钠溶液中加入2g氯化钠固体,振荡;
D.将20℃饱和的石灰水升温至80℃.
【答案】分析:(1)根据固体溶于液体,固体是溶质,液体是溶剂考虑;(2)①根据溶解度曲线的交点表示的意义考虑;②根据10℃氯化钠和硫酸钠的溶解度大小考虑;③根据溶解度曲线考虑;(3)有晶体析出使溶液变混浊.
解答:解:(1)硫酸钠溶液是硫酸钠固体溶于水,所以硫酸钠是溶质,水是溶剂;
(2)①溶解度曲线的交点表示该温度下两种物质的溶解度相等;由图示可知25℃两种物质的溶解度相等;
②10℃硫酸钠的溶解度小,所以降温至10℃,有晶体析出.则析出的晶体中主要成分是硫酸钠;
③由溶解度曲线图可知在0℃-40℃温度范围内,硫酸钠溶解度随温度变化的趋势是随温度的升高而增大;
(3)有晶体析出时会使溶液变浑浊.向盛满CO2的集气瓶中倒入少量澄清的石灰水,由于二氧化碳与氢氧化钙反应生成碳酸钙沉淀,所以变浑浊;.20℃时食盐的溶解度是36g,饱和溶液的质量分数是: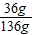 ×100%=26.5%,所以20℃时26.5%的食盐水已经饱和,再加食盐不能再溶解,会有不溶物,变浑浊;一定温度下,向饱和的氯化钠溶液中加入2g氯化钠固体不能再溶解,所以溶液变浑浊;将20℃饱和的石灰水升温至80℃溶解度变小,会析出晶体,所以溶液变浑浊.
×100%=26.5%,所以20℃时26.5%的食盐水已经饱和,再加食盐不能再溶解,会有不溶物,变浑浊;一定温度下,向饱和的氯化钠溶液中加入2g氯化钠固体不能再溶解,所以溶液变浑浊;将20℃饱和的石灰水升温至80℃溶解度变小,会析出晶体,所以溶液变浑浊.
故答案为:(1)硫酸钠;水;(2)①25;②硫酸钠;③随温度的升高而增大;(3)ABCD.
点评:解答本题关键是要知道溶质和溶剂的判断方法,熟悉溶解度曲线表示的意义,知道有晶体析出时会使溶液变浑浊.
解答:解:(1)硫酸钠溶液是硫酸钠固体溶于水,所以硫酸钠是溶质,水是溶剂;
(2)①溶解度曲线的交点表示该温度下两种物质的溶解度相等;由图示可知25℃两种物质的溶解度相等;
②10℃硫酸钠的溶解度小,所以降温至10℃,有晶体析出.则析出的晶体中主要成分是硫酸钠;
③由溶解度曲线图可知在0℃-40℃温度范围内,硫酸钠溶解度随温度变化的趋势是随温度的升高而增大;
(3)有晶体析出时会使溶液变浑浊.向盛满CO2的集气瓶中倒入少量澄清的石灰水,由于二氧化碳与氢氧化钙反应生成碳酸钙沉淀,所以变浑浊;.20℃时食盐的溶解度是36g,饱和溶液的质量分数是:
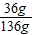 ×100%=26.5%,所以20℃时26.5%的食盐水已经饱和,再加食盐不能再溶解,会有不溶物,变浑浊;一定温度下,向饱和的氯化钠溶液中加入2g氯化钠固体不能再溶解,所以溶液变浑浊;将20℃饱和的石灰水升温至80℃溶解度变小,会析出晶体,所以溶液变浑浊.
×100%=26.5%,所以20℃时26.5%的食盐水已经饱和,再加食盐不能再溶解,会有不溶物,变浑浊;一定温度下,向饱和的氯化钠溶液中加入2g氯化钠固体不能再溶解,所以溶液变浑浊;将20℃饱和的石灰水升温至80℃溶解度变小,会析出晶体,所以溶液变浑浊.故答案为:(1)硫酸钠;水;(2)①25;②硫酸钠;③随温度的升高而增大;(3)ABCD.
点评:解答本题关键是要知道溶质和溶剂的判断方法,熟悉溶解度曲线表示的意义,知道有晶体析出时会使溶液变浑浊.

练习册系列答案
相关题目
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为 g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
(3)熟石灰是一种重要的碱,在工农生产和日常生活中都有十分广泛的应用.工业上首先是用大理石(主要成分碳酸钙)高温煅烧来制取生石灰,然后再用生石灰与水反应来制取熟石灰.请你写出有关反应的化学方程式.
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是 .
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
(5)若73 g质量分数为20%的盐酸与127g氢氧化钠溶液恰好完全中和,试计算反应后所得溶液中溶质的质量分数.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 |
取少量该固体样品溶于水配成溶液,滴加适量的 充分反应后过滤 |
有白色沉淀生成 |
有关反应的化学方程式为 |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | 该样品中含有氢氧化钠 |
酸、碱、盐是有广泛用途的重要化合物.某化学活动小组的同学围绕这几类化合物进行了一系列的探究活动.
(1)同学们打开盛浓盐酸和浓硫酸试剂瓶的瓶盖,立即就能把它们区分开来,这是为什么?
(2)如图是某试剂瓶标签上的内容.要把30 g这种浓硫酸稀释为40%的硫酸,需要水的质量为______g.稀释浓硫酸时,不可将水倒进浓硫酸里,请解释其原因.
| 浓硫酸(分析纯) 化学式:H2SO4 相对分子质量:98 密度:1.84g/cm3 质量分数:98% |
(4)为探究一瓶氢氧化钠固体的变质情况,同学们进行了如下实验.
①取少量该固体样品置于试管中,向其中加入一种无色溶液,发现有气泡产生,说明该样品中含有碳酸钠,由此可确定该固体已发生变质.则无色溶液可能是______.
②为探究该固体中是否还有未变质的氢氧化钠,同学们又进行了如下表所示的实验.已知碳酸钠的水溶液呈碱性,它的存在会对氢氧化钠的检验造成干扰.请根据图中部分物质的溶解性表(20℃)所提供的信息,将下表填写完整.
| 阳离子\阴离子 | OH- | NO3- | Cl- | SO42- | CO32- |
| H+ | 溶、挥 | 溶、挥 | 溶 | 溶、挥 | |
| Na+ | 溶 | 溶 | 溶 | 溶 | 溶 |
| Ba2+ | 溶 | 溶 | 溶 | 不溶 | 不溶 |
| 实验目的 | 实验操作 | 现象 | 结论或化学方程式 |
除去碳酸钠 | 取少量该固体样品溶于水配成溶液,滴加适量的______溶液, 充分反应后过滤 | 有白色沉淀生成 | 有关反应的化学方程式为 ______ |
| 检验是否含有氢氧化钠 | 在滤液中滴加酚酞溶液 | ______ | 该样品中含有氢氧化钠 |