题目内容
(2009?南开区二模)实验室通常使用大理石(主要成分为CaCO3)和稀盐酸反应制取二氧化碳.(1)CaCO3的相对分子质量为.
(2)某同学称取了12g含CaCO3纯度为75%的大理石,其中所含CaCO3的质量是g.
(3)上述大理石理论上可以制得二氧化碳质量为.
【答案】分析:(1)相对分子质量=各元素原子量之和;
(2)物质的质量=样品的质量×物质的纯度;
(3)利用碳酸钙的质量结合化学方程式的计算完成即可.
解答:解:(1)相对分子质量=各元素原子量之和,所以其相对分子质量=40+12+16×3=100.
(2)物质的质量=样品的质量×物质的纯度;所以碳酸钙的质量=12g×75%=9g
(3)设可生成二氧化碳的质量是x
CaCO3 CaO+CO2↑
CaO+CO2↑
100 44
9g x
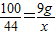
x=3.96g
故答案为:(1)100;(2)9;(3)3.96g.
点评:此题是对碳酸钙知识的考查题,解题时主要利用了化学式的计算以及化学方程式的计算解决问题.
(2)物质的质量=样品的质量×物质的纯度;
(3)利用碳酸钙的质量结合化学方程式的计算完成即可.
解答:解:(1)相对分子质量=各元素原子量之和,所以其相对分子质量=40+12+16×3=100.
(2)物质的质量=样品的质量×物质的纯度;所以碳酸钙的质量=12g×75%=9g
(3)设可生成二氧化碳的质量是x
CaCO3
 CaO+CO2↑
CaO+CO2↑100 44
9g x
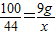
x=3.96g
故答案为:(1)100;(2)9;(3)3.96g.
点评:此题是对碳酸钙知识的考查题,解题时主要利用了化学式的计算以及化学方程式的计算解决问题.

练习册系列答案
 字词句篇与同步作文达标系列答案
字词句篇与同步作文达标系列答案
相关题目
(2009?南开区二模)为除去Na2SO4溶液中含有的杂质Na2CO3,甲、乙、丙三位同学分别选用一种试剂(适量)进行实验.请你对他们所选用的试剂进行评价:
| 学生 | 选用试剂 | 评价(是否可行,并简述理由) |
| 甲 | HCl | |
| 乙 | H2SO4 | |
| 丙 | Ba(OH)2 |
(2009?南开区二模)学习了溶液的概念后,老师的提问及同学的回答如下图所示:
(1)以上三位同学中能够正确描述溶液特征的是同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).
(3)该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,A物质的饱和溶液溶质质量分数大于B物质的饱和溶液溶质质量分数,该温度范围是.
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量AB(填“大于”、“等于”或“小于”).
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是g.


(1)以上三位同学中能够正确描述溶液特征的是同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).
| 温度/℃ | 20 | 40 | 60 | ||
| 溶解度/g | A物质 | 30 | 35 | 41 | 50 |
| B物质 | 25 | 35 | 55 | 90 | |
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量AB(填“大于”、“等于”或“小于”).
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是g.

(2009?南开区二模)学习了溶液的概念后,老师的提问及同学的回答如下图所示:
(1)以上三位同学中能够正确描述溶液特征的是同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).
(3)该实验主要探究了温度对固体物质溶解度的影响,在一定温度范围内,A物质的饱和溶液溶质质量分数大于B物质的饱和溶液溶质质量分数,该温度范围是.
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量AB(填“大于”、“等于”或“小于”).
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是g.


(1)以上三位同学中能够正确描述溶液特征的是同学.老师接着问:“你们还想知道什么?”王华回答:“影响物质在水中溶解能力的因素有哪些?”
(2)针对王华的问题,老师引导同学们进行了一系列探究,下表列出了从探究实验中获取的部分数据,请你根据这些下表中的数据,在右边的坐标图中绘制A、B两物质的溶解度曲线(图中注明A、B).
| 温度/℃ | 20 | 40 | 60 | ||
| 溶解度/g | A物质 | 30 | 35 | 41 | 50 |
| B物质 | 25 | 35 | 55 | 90 | |
(4)将在20゜C时等量的A、B饱和溶液同时降温到10゜C,则析出晶体的质量AB(填“大于”、“等于”或“小于”).
(5)在20゜C时,向100g水中加入40gA物质充分溶解后,形成的A物质溶液质量是g.

