题目内容
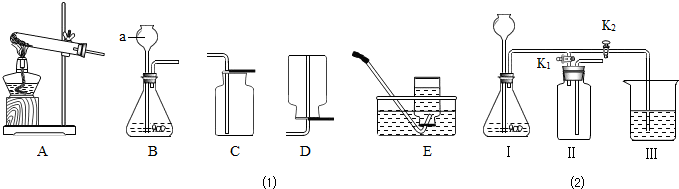
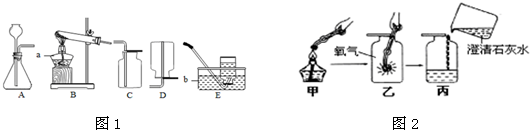
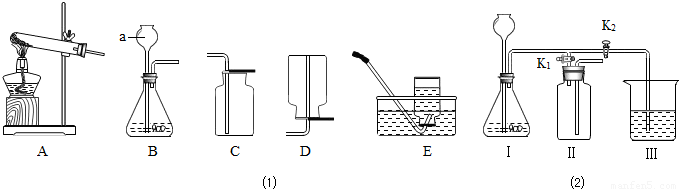
某化学兴趣小组利用图1装置探究制取气体的原理、方法及性质.结合装置图,回答下列问题: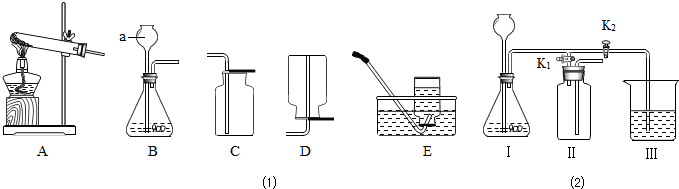
(1)写出图中标号仪器的名称:a______.
(2)用双氧水和二氧化锰制取氧气的化学反应方程式为______,可选用上图中的B、C组合装置来进行制取和收集,其验满的方法是______.
(3)实验室常用氯化铵固体与碱石灰固体共热来制取氨气(NH3),已知氨气的密度比空气小且极易溶于水.若要制取并收集氨气应选的装置组合是______(填序号),将收集满氨气的集气瓶倒扣在滴有无色酚酞的水中,观察到的现象是______.
(4)该小组设计了如图2所示的实验装置,既可用于制取气体,又可用于探究物质性质. ①当打开K1、关闭K2时,可用于实验室制取并收集______,该反应的化学方程式为______.
②当打开K2、关闭K1时,可以利用此装置制得二氧化碳并验证其性质.若要证明二氧化碳能与水发生反应,应向烧杯的水中加入______.
解:(1)a是长颈漏斗;
(2)过氧化氢在二氧化锰的作用下分解成水和氧气,反应的方程式为:2H2O2 2H2O+O2↑;验满氧气用带火星的木条放在集气瓶口看是否复燃;
2H2O+O2↑;验满氧气用带火星的木条放在集气瓶口看是否复燃;
(3)该反应物的发生装置是固固加热型(A),氨气的密度比空气小且极易溶于水,采用向下排空气法收集(D);因为氨气易溶于水,且水溶液显碱性,故看到的现象是:集气瓶内水面上升,由无色变为红色;
(4)①该装置适合制取固液常温反应,且密度比空气密度小的气体,如氢气,可以用活泼金属与酸反应来制取,反应的方程式为:Zn+H2SO4═ZnSO4+H2↑(或Zn+2HCl═ZnCl2+H2↑);②二氧化碳的水溶液显酸性,能够使紫色的石蕊试液变成红色.
故答案为:(1)长颈漏斗; (2)2H2O2 2H2O+O2↑ 用带火星的木条放在集气瓶口,看是否复燃
2H2O+O2↑ 用带火星的木条放在集气瓶口,看是否复燃
(3)AD 集气瓶内水面上升,由无色变为红色
(4)①氢气(或H2) Zn+H2SO4═ZnSO4+H2↑(或Zn+2HCl═ZnCl2+H2↑)
②紫色石蕊试液
分析:(1)熟练掌握常见的化学仪器名称和用途;
(2)过氧化氢在二氧化锰的作用下分解成水和氧气;验满氧气用带火星的木条放在集气瓶口看是否复燃;
(3)根据反应物的状态和反应条件属于固固加热型选择发生装置,根据密度和溶解性选择收集装置;根据氨气的溶解性及性质分析现象;
(4)①该装置适合固液常温型制取气体,并且气体的密度比空气小;
②二氧化碳的水溶液显酸性,能够使紫色的石蕊试液变成红色.
点评:本题考查了气体的制取和性质的检验,是中考必考的知识点,要求学生平时学习要扎实基础,灵活运用.
(2)过氧化氢在二氧化锰的作用下分解成水和氧气,反应的方程式为:2H2O2
 2H2O+O2↑;验满氧气用带火星的木条放在集气瓶口看是否复燃;
2H2O+O2↑;验满氧气用带火星的木条放在集气瓶口看是否复燃;(3)该反应物的发生装置是固固加热型(A),氨气的密度比空气小且极易溶于水,采用向下排空气法收集(D);因为氨气易溶于水,且水溶液显碱性,故看到的现象是:集气瓶内水面上升,由无色变为红色;
(4)①该装置适合制取固液常温反应,且密度比空气密度小的气体,如氢气,可以用活泼金属与酸反应来制取,反应的方程式为:Zn+H2SO4═ZnSO4+H2↑(或Zn+2HCl═ZnCl2+H2↑);②二氧化碳的水溶液显酸性,能够使紫色的石蕊试液变成红色.
故答案为:(1)长颈漏斗; (2)2H2O2
 2H2O+O2↑ 用带火星的木条放在集气瓶口,看是否复燃
2H2O+O2↑ 用带火星的木条放在集气瓶口,看是否复燃(3)AD 集气瓶内水面上升,由无色变为红色
(4)①氢气(或H2) Zn+H2SO4═ZnSO4+H2↑(或Zn+2HCl═ZnCl2+H2↑)
②紫色石蕊试液
分析:(1)熟练掌握常见的化学仪器名称和用途;
(2)过氧化氢在二氧化锰的作用下分解成水和氧气;验满氧气用带火星的木条放在集气瓶口看是否复燃;
(3)根据反应物的状态和反应条件属于固固加热型选择发生装置,根据密度和溶解性选择收集装置;根据氨气的溶解性及性质分析现象;
(4)①该装置适合固液常温型制取气体,并且气体的密度比空气小;
②二氧化碳的水溶液显酸性,能够使紫色的石蕊试液变成红色.
点评:本题考查了气体的制取和性质的检验,是中考必考的知识点,要求学生平时学习要扎实基础,灵活运用.

练习册系列答案
 同步轻松练习系列答案
同步轻松练习系列答案 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案
相关题目