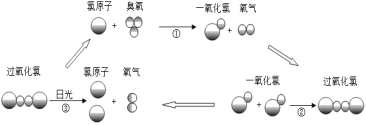
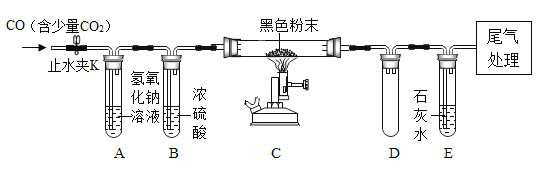
题目内容
【题目】图 I是元素周期表的一部分
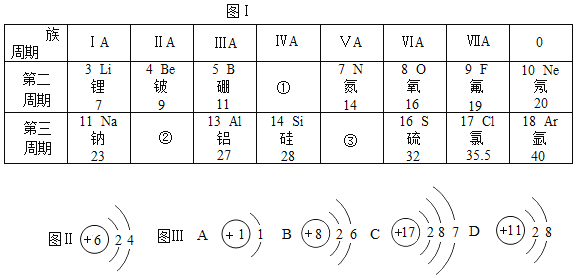
(1)核外电子数为14的原子对应元素名称为_____;
(2)图II是某元素的原子结构示意图,该元素在图I中的位置是_____(填①、②或③)
(3)图 III中阳离子是_____(填序号),C容易_____电子(填“得”或“失”),形成_____(填离子符号),二者形成的化合物的化学式为_____。
【答案】硅元素 ① D 得 Cl﹣ NaCl
【解析】
(1)核外电子数为14的原子对应元素名称为硅元素。
故填:硅元素。
(2)图II是某元素的原子结构示意图,该元素是碳元素,在图I中的位置是①。
故填:①。
(3)图 III中阳离子是带1个单位电荷的钠离子,可以表示为Na+,序号为D,C是氯原子,最外层电子数是7,反应中容易得到电子,形成带1个单位负电荷的氯离子,可以表示为Cl﹣,钠离子和氯离子形成的化合物的化学式为NaCl。
故填:D;得;Cl﹣;NaCl。

练习册系列答案
相关题目