题目内容
【题目】金属材料在生活生产中有着非常广泛的应用。
(1)金属大规模开发利用的先后顺序与下列________因素有关。
①金属在自然界中的含量 ②金属冶炼的难易程度 ③金属的导电性 ④金属的活泼性
(2)按下图装置连接好仪器(铁架台夹持固定等仪器已略去)检查装置的气密性,往装置中添加药品,打开止水夹K通入含有少量二氧化碳的的一氧化碳,一段时间后再点燃酒精喷灯。
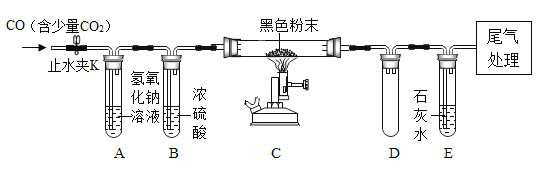
①实验中观察到装置C中固体仍为黑色,而装置E中石灰水变浑浊,则硬质玻璃管中发生反应的化学方程式为__________________________________。
②装置D的作用是____________?
③实验结束后,请设计合理的实验方案检验A装置内还含有氢氧化钠,简要写出实验步骤、现象和结论___________________________。
(3)将6.5g含有一种杂质的锌粉与足量稀硫酸反应,生成0.18g氢气,则该锌粉中混有的杂质是______(填“铜”或“镁”)。把这种锌粉放入硝酸银溶液中,充分反应后过滤,向滤液中加入稀盐酸,有白色沉淀产生,则滤液中含有的溶质是____________(写化学式)。请解释反应后溶液质量减少的原因_____________________。
(4)某同学将铁粉和铜粉的混合物50g,放入足量的氯化铜溶液中,充分反应后过滤,干燥,称得固体总质量为54g。求原混合物中铁的质量分数__________________。
【答案】②④ 4CO+Fe3O4![]() 3Fe+4CO2 防止石灰水到流入硬质玻璃管内,使玻璃管炸裂 取实验后A中的溶液少许于试管内,加入过量的氯化钡(合理即可)溶液,静置,向上层清夜中加入酚酞溶液,溶液变红,说明有氢氧化钠 铜 AgNO3、 Cu(NO3)2 、Zn(NO3)2 生成的硝酸锌和硝酸铜的质量小于参加反应的硝酸银的质量 56%
3Fe+4CO2 防止石灰水到流入硬质玻璃管内,使玻璃管炸裂 取实验后A中的溶液少许于试管内,加入过量的氯化钡(合理即可)溶液,静置,向上层清夜中加入酚酞溶液,溶液变红,说明有氢氧化钠 铜 AgNO3、 Cu(NO3)2 、Zn(NO3)2 生成的硝酸锌和硝酸铜的质量小于参加反应的硝酸银的质量 56%
【解析】
(1)金属大规模开发利用的先后顺序与金属冶炼的难易程度和金属的活泼性等因素有关,与自然界的含量和导电性无关;故填:②④
(2)①反应前,固体为黑色,实验中观察到装置C中固体仍为黑色,而装置E中石灰水变浑浊,说明已经发生了反应,可知该氧化物为黑色,该单质也为黑色,可以推测反应前的黑色粉末为四氧化三铁,反应后的产物是黑色铁粉,则硬质玻璃管中发生反应的化学方程式为:4CO+Fe3O4![]() 3Fe+4CO2;故填:4CO+Fe3O4
3Fe+4CO2;故填:4CO+Fe3O4![]() 3Fe+4CO2
3Fe+4CO2
②装置D为一个空的试管,其作用是:防止石灰水到流入硬质玻璃管内,使玻璃管炸裂;故填:防止石灰水到流入硬质玻璃管内,使玻璃管炸裂
③装置A的作用是吸收二氧化碳,吸收二氧化碳后生成碳酸钠,实验结束后,可以通过滴加酚酞来检验氢氧化钠是否还有剩余,但是碳酸钠也呈碱性,因此要先除去才能检验氢氧化钠;合理的实验方案为:取实验后A中的溶液少许于试管内,加入过量的氯化钡(合理即可)溶液,静置,向上层清夜中加入酚酞溶液,溶液变红,说明有氢氧化钠。故填:取实验后A中的溶液少许于试管内,加入过量的氯化钡(合理即可)溶液,静置,向上层清夜中加入酚酞溶液,溶液变红,说明有氢氧化钠
(3)解:锌、镁和稀硫酸反应的化学方程式及其质量关系为:
![]()
![]()
由以上质量关系可知,6.5g锌和稀硫酸完全反应时生成0.2g氢气,如果锌中含有镁时反应生成的氢气质量应该大于0.2g,因此该锌粉中混有的杂质是铜;锌先和硝酸银反应生成硝酸锌和银,后铜和硝酸银反应生成硝酸铜和银,充分反应后过滤,向滤液中加入稀盐酸,有白色沉淀产生,说明硝酸银有剩余,则滤液中含有的溶质是AgNO3、 Cu(NO3)2 、Zn(NO3)2;由于银的相对原子质量比锌和铜的都大,不管发生哪一步反应,都会置换出溶液中的银,因此生成的硝酸锌和硝酸铜的质量小于参加反应的硝酸银的质量;故填:铜;AgNO3、Cu(NO3)2、Zn(NO3)2;生成的硝酸锌和硝酸铜的质量小于参加反应的硝酸银的质量
(4)解:设原混合物中铁的质量为x。
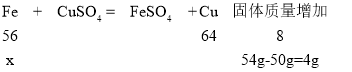
![]()
x=28g。
原混合物中铁的质量分数为:![]() ;故填:56%
;故填:56%

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案