题目内容
【题目】溶液在生活、生产中具有广泛的用途。
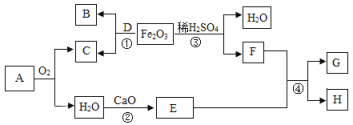
(1)在20℃时,将20g氯化钾固体加入50g水中,充分搅拌后,仍有3g氯化钾固体未溶解。所得溶液中氯化钾的质量分数为_____(计算结果保留一位数);20℃时氯化钾的溶解度______。
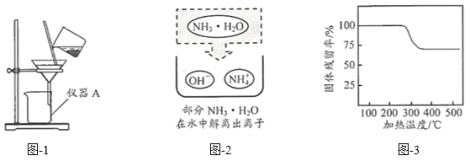
(2)甲、乙两种不含结晶水的固体物质的溶解度曲线如图。t1℃时,甲溶液的溶质质量分数与乙溶液的溶质质量分数相比,前者与后者的关系是_____(填字母)。
A 大于 B 小于 C 等于 D 无法确定
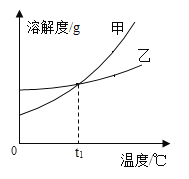
(3)下图是实验室稀释浓硫酸的正确和错误操作,请说明不能将水直接倒入浓硫酸中进行稀释的原因______。
【答案】25.4% 34g D 浓硫酸的密度比水大,水会浮在浓硫酸上面,浓硫酸溶于水产生的热量不能散失,造成液滴飞溅
【解析】
(1)所得溶液中氯化钾的质量分数为![]() ×100%≈25.4%,故填25.4%;
×100%≈25.4%,故填25.4%;
20℃时,50g水中溶解17g氯化钾形成饱和溶液,则100g水中加入氯化钾形成饱和溶液时溶解的氯化钾的质量为34g,所以20℃时,氯化钾的溶解度为34g,故填34g。
(2)由图可知,t1℃时,甲、乙两种物质的溶解度相同,则t1℃时甲、乙两种物质的饱和溶液的溶质质量分数相同,题目中未指明甲、乙两种溶液的状态,所以无法确定两种溶液的溶质质量分数的关系,故填D。
(3)稀释浓硫酸时不能将水直接倒入浓硫酸中的原因是:浓硫酸的密度比水大,水会浮在浓硫酸上面,浓硫酸溶于水产生的热量不能散失,水受热会沸腾造成液滴飞溅,故填浓硫酸的密度比水大,水会浮在浓硫酸上面,浓硫酸溶于水产生的热量不能散失,造成液滴飞溅。

 鹰派教辅衔接教材河北教育出版社系列答案
鹰派教辅衔接教材河北教育出版社系列答案 初中暑期衔接系列答案
初中暑期衔接系列答案【题目】小华与朋友聚餐时,对火锅燃料“固体酒精”产生了好奇,于是他与同学对其成分进行如下探究。
(发现问题)小华观察发现,固体酒精完全燃烧后会残留少量白色固体。
(提出问题)燃烧后残留的白色固体是什么?
(查阅资料)固体酒精是酒精、氢氧化钠和凝固剂按一定的质量比混合制成,该凝固剂在空气中能完全燃烧生成二氧化碳和水。
(作出猜想)猜想一:氢氧化钠 猜想二:碳酸钠 猜想三:_____。
你认为猜想中含有碳酸钠的理由是_____(用化学方程式表示)
(实验探究)
步骤 | 实验操作 | 实验现象 | 结论 |
(1) | 将白色固体溶于足量水中 | 白色固体全部溶解 | 固体可溶于水 |
(2) | 取(1)所得少量溶液,加入过量的BaCl2溶液 | _____ | 白色固体中肯定有Na2CO3 |
(3) | 取(2)所得少量上层清液,加入_____溶液 | 有蓝色沉淀生成 | 白色固体中肯定有_____ |
(反思交流)实验中,加入过量氯化钡溶液的目的是_____,如果实验中发现氯化钡溶液不够,可选用下列试剂代替也能达到实验目的是_____。
A Ca(OH)2溶液 B Ba(NO3)2溶液 C 稀盐酸 D CaCl2溶液