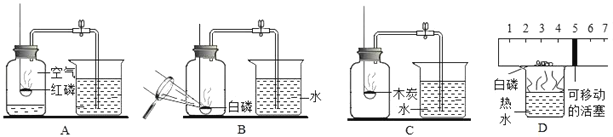
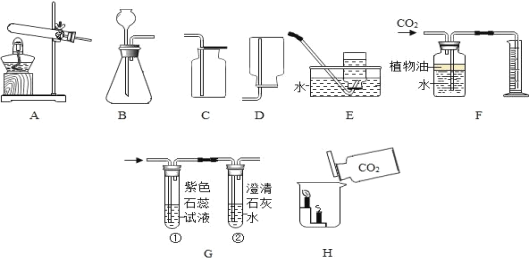
题目内容
【题目】以镁矿石(主要成分MgCO3、SiO2)为原料生产MgO的工艺流程如下:
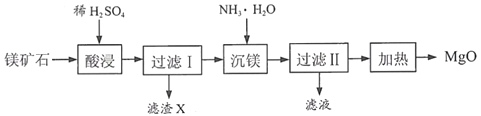
注:SiO2难溶于水和常见的酸;“沉镁”过程中有Mg(OH)2生成。
(1)滤渣X的主要成分为______(填化学式)。
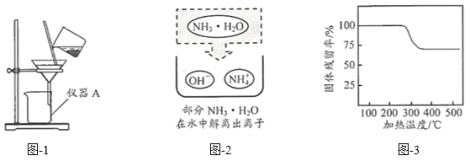
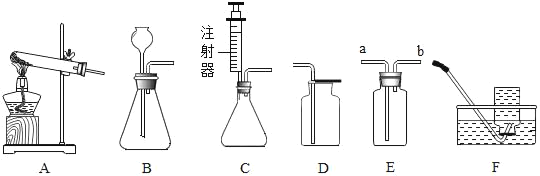
(2)实验室中用图-1所示装置进行过滤。
①该装置中仪器A的名称为______。
②若过滤时滤液出现浑浊,可能的原因是______(填字母)。
a.滤纸已破损 b.漏斗中液面低于滤纸边缘 c.滤纸未紧贴漏斗内壁
(3)“沉镁”时MgSO4与NH3·H2O发生反应。结合图-2,写出该反应的化学方程式:______。
(4)已知在不同温度下,充分加热等质量的Mg(OH)2,加热温度与固体残留率的关系如图-3所示。“加热”时温度至少要达到350℃,原因是______。
【答案】SiO2 烧杯 a MgSO4+2NH3·H2O=Mg(OH)2↓+(NH4)2SO4 低于350℃时,氢氧化镁不能完全分解,导致氧化镁不纯
【解析】
(1)SiO2难溶于水和常见的酸,故滤渣X的主要成分为:SiO2;
(2)①仪器A的名称为:烧杯;
②若过滤时滤液出现浑浊,可能的原因是:滤纸破损或待过滤液体的液面高于滤纸边缘,故选a;
(3)“沉镁”时MgSO4与NH3·H2O发生反应,生成氢氧化镁和硫酸铵,反应的化学方程式为:MgSO4+2NH3·H2O=Mg(OH)2↓+(NH4)2SO4;
(4) “加热”时温度至少要达到350℃,原因是:低于350℃时,氢氧化镁不能完全分解,导致氧化镁不纯。

练习册系列答案
相关题目