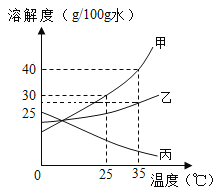
题目内容
【题目】我国约在南北朝时就开始冶炼黄铜,黄铜是铜和锌的合金。为了测定某黄铜中铜的质量分数,称取10.0 g黄铜样品置于烧杯中,慢慢加入稀硫酸使其充分反应,直至固体质量不再减少为止,此时共用去49.0 g稀硫酸,将反应后的剩余物过滤、干燥,称得剩余固体3.5 g。试计算:(Zn + H2SO4 = ZnSO4 + H2↑)
(1)黄铜样品中铜的质量分数;________________
(2)所用稀硫酸中含硫酸的质量。________________
【答案】35% 9.8g
【解析】
根据金属活动性锌>氢>铜,黄铜加入稀硫酸时,锌与硫酸反应生成硫酸锌同时放出氢气而铜不能与稀硫酸反应,因此充分反应后剩余固体为不能反应的铜,则可得到参加反应锌的质量6.5g,利用锌的质量计算出所消耗的稀硫酸溶液中硫酸的质量,最后利用溶质质量分数计算公式计算出稀硫酸溶质的质量分数。
(1)铜的质量分数=![]() ;
;
(2)10.0g黄铜样品中锌的质量=10g-3.5g=6.5g,设所用稀硫酸溶质的质量为x。
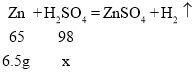
![]()
x=9.8g
答:(1) 该黄铜中铜的质量分数为35%;(2)所用稀硫酸中含硫酸的质量为9.8g。

练习册系列答案
 阳光课堂课时作业系列答案
阳光课堂课时作业系列答案
相关题目