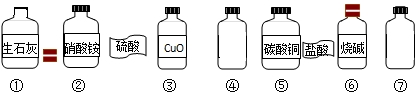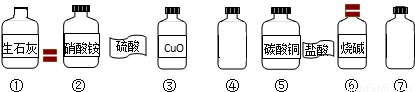题目内容
在一次学生分组实验之后,小红同学利用课外活动时间来到实验室帮助老师整理实验药品.在一个实验台前,小红发现实验台上散乱地摆放着下列药品.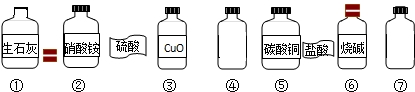
(1)小红发现有两瓶盛有无色溶液的试剂瓶④⑦,标签已经脱落,分别是硫酸和盐酸.请你帮助他设计一个小实验来鉴别两瓶试剂.(写出实验方法和判断依据)
(2)小红将脱落的标签贴上后,他按氧化物、酸、碱、盐的顺序将七种药品分类摆放,请根据他的分类的情况用序号填空:氧化物
(3)小红从上面七种药品选择两种,他准备做一个中和反应的实验.他在做中和反应实验时为了便于观察反应是否发生,他在所取的少量溶液中加入几滴酚酞试液,试液变红,当他向所取的溶液中再滴加酸时,观察到红色变成无色.根据实验现象写出一个中和反应的化学方程式.
(4)小红还发现试剂瓶①没有盖上瓶塞,一直敞口放置着.他猜想可能有一部分生石灰已变质生成了碳酸钙.为确认这一猜想,小红称取了10g样品(假设样品中只含有生石灰和碳酸钙,且混合均匀),加入过量稀盐酸60g,至样品不再有气体放出为止,称量反应残余物质质量为69.56g.他根据有关的数据确认了生石灰发生了变质及变质的程度,请你计算此瓶生石灰的纯度.
分析:(1)根据硫酸和盐酸的酸根的不同,通过使用择氯化钡溶液来鉴别这两种酸;滴加氯化钡出现白色沉淀的酸为硫酸,没明显现象的酸为盐酸;
(2)氧化物是指由两元素组成且含O元素的化合物;判断时首先确定含氧元素然后还要满足只有两种元素的要求;
(3)中和反应是指酸与碱生成盐和水的反应,在所列出的七种药品中只有氢氧化钠为碱,而酸有盐酸、硫酸两种,因此可写出氢氧化钠与硫酸或盐酸反应的化学方程式;
(4)生石灰与盐酸反应生成水和氯化钙,不产生气体,因此不会影响反应前后物质的总质量;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,由于放出气体二氧化碳而使反应后物质总质量减小;根据反应前后物质质量变化即二氧化碳的质量可计算参加反应的碳酸钙的质量;样品质量与碳酸钙质量的差值即样品中氧化钙的质量,氧化钙质量与样品质量比即氧化钙纯度.
(2)氧化物是指由两元素组成且含O元素的化合物;判断时首先确定含氧元素然后还要满足只有两种元素的要求;
(3)中和反应是指酸与碱生成盐和水的反应,在所列出的七种药品中只有氢氧化钠为碱,而酸有盐酸、硫酸两种,因此可写出氢氧化钠与硫酸或盐酸反应的化学方程式;
(4)生石灰与盐酸反应生成水和氯化钙,不产生气体,因此不会影响反应前后物质的总质量;碳酸钙与盐酸反应生成氯化钙、水和二氧化碳,由于放出气体二氧化碳而使反应后物质总质量减小;根据反应前后物质质量变化即二氧化碳的质量可计算参加反应的碳酸钙的质量;样品质量与碳酸钙质量的差值即样品中氧化钙的质量,氧化钙质量与样品质量比即氧化钙纯度.
解答:解:(1)鉴别盐酸和硫酸可采取滴加硝酸钡或氯化钡溶液观察是否产生沉淀的方法,生成白色沉淀的为硫酸,盐酸与硝酸钡或氯化钡溶液不发生反应,因而无明显现象;
故答案为:分别向④⑦两种溶液分别加硝酸钡溶液[或BaCl2溶液],有沉淀生成的为稀硫酸,无沉淀生成的为稀盐酸;
(2)由两种元素组成且含氧元素的物质为氧化物,生石灰为氧化钙的俗称,由钙、氧两种元素组成,CuO为铜和氧元素组成,所以生石灰和CuO都属于氧化物;
故答案为:①③;
(3)酸与碱生成盐和水的反应称为中和反应,烧碱为氢氧化钠的俗称属于碱,硫酸、盐酸都属于酸,所以,可选择氢氧化钠与硫酸或盐酸反应,与硫酸反应生成硫酸钠和水,与盐酸反应生成氯化钠和水;
故答案为:HCl+NaOH=NaCl+H2O(或H2SO4+2NaOH=Na2SO4+2H2O);
(4)反应放出二氧化碳气体质量=10g+60g-69.56g=0.44g
设放出0.44gCO2时参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
=
x=1g
则此瓶生石灰的纯度=
×100%=90%
答:此瓶生石灰的纯度为90%.
故答案为:分别向④⑦两种溶液分别加硝酸钡溶液[或BaCl2溶液],有沉淀生成的为稀硫酸,无沉淀生成的为稀盐酸;
(2)由两种元素组成且含氧元素的物质为氧化物,生石灰为氧化钙的俗称,由钙、氧两种元素组成,CuO为铜和氧元素组成,所以生石灰和CuO都属于氧化物;
故答案为:①③;
(3)酸与碱生成盐和水的反应称为中和反应,烧碱为氢氧化钠的俗称属于碱,硫酸、盐酸都属于酸,所以,可选择氢氧化钠与硫酸或盐酸反应,与硫酸反应生成硫酸钠和水,与盐酸反应生成氯化钠和水;
故答案为:HCl+NaOH=NaCl+H2O(或H2SO4+2NaOH=Na2SO4+2H2O);
(4)反应放出二氧化碳气体质量=10g+60g-69.56g=0.44g
设放出0.44gCO2时参加反应的碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.44g
| 100 |
| x |
| 44 |
| 0.44g |
x=1g
则此瓶生石灰的纯度=
| 10g-1g |
| 10g |
答:此瓶生石灰的纯度为90%.
点评:根据物质的组成可把化合物分为:氧化物,两种元素且含氧的化合物;碱,金属和氢氧根组成的化合物;酸,氢和酸根组成的化合物;盐,金属和酸根组成的化合物.

练习册系列答案
相关题目