��Ŀ����
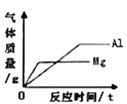
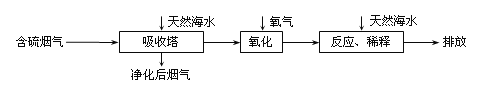
����Ŀ����Ȼ��ˮ�������ԣ����ú�ˮ�����Ǽ���SO2�ŷŵ���Ч�������乤����������ͼ��ʾ��
�����˽϶�ĺ�����������H2SO3���ɣ�ͨ�������������Ϸ�Ӧ��ˮ������������ǿ��
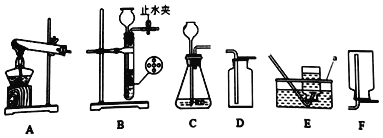
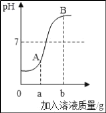
�����һ�ּ��龻������������Ƿ�SO2�ļ�ʵ�鷽����____��
���û�ѧ����ʽ��ʾ��ˮ������ǿ��ԭ��____��
��������ĺ�ˮ��Ҫ�ô�������Ȼ��ˮ��֮��Ϻ�����ŷţ��ò�������ҪĿ����____��
��ijͬѧȡһ����������Ʒ�����뺬Ca(OH)2 7.4%��ʯ�ҽ��������е�SO2��ǡ����ȫ����ʱ����ʯ�ҽ�10.00g�����������Ʒ���ܽ�SO2������Ϊ___�ˣ���д��������̣�
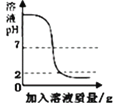
���𰸡��������������ͨ��Ʒ����Һ������Һ��ɫ�����к���SO2����֮���� ![]() ��
��![]() Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ 0.64
Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ 0.64
��������
�ٿ�����Ʒ����Һ�����飬����������������ͨ��Ʒ����Һ������Һ��ɫ�����к���SO2����֮���ޡ�
�ڸ������⣬��ˮ������ǿ���������˽϶�ĺ�����������H2SO3���ɣ�ͨ�������������Ϸ�Ӧ�����![]() ��
��![]() ��
��
��������ĺ�ˮ��Ҫ�ô�������Ȼ��ˮ��֮��Ϻ�����ŷţ��ò�������ҪĿ����Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ�����Ϊ�˽��ͺ�ˮ�����ԣ�������Ⱦ��
�ܽ⣺����Ʒ���ܽ�SO2������Ϊx��
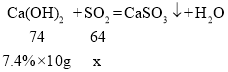
![]()
x=0.64g
�𣺸�������Ʒ���ܽ�SO2������Ϊ0.64�ˡ�

 �������ϵ�д�
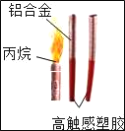
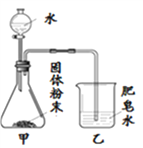
�������ϵ�д�����Ŀ����ͼ�ļ��ȴ�������Ұ�����ʳ����ȴ��еĹ����ĩ��þ�ۡ����ۺ��Ȼ��ƣ�ʹ��ʱ�����м���ˮ���е�ˮ�����ɲ��������ȡ�ʵ��С����Է��ȹ����еķ�Ӧԭ��չ��̽����


���������ϡ�
������þ������ˮ�����û���Ӧ���ҷ��ȡ�
������ʵ�顿
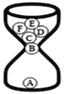
ͬѧ������ͼ��ʾװ�ý���ģ��ʵ�飺�ֱ�ȡ��ͬ�ɷֵĹ����ĩ������У�ͨ����Һ©�������о�����8 mLˮ����ȡ�������ù�Һ����������¶ȣ�ʵ���¼���±���
��ʵ��ʱ������Ϊ22.8�棩
ʵ����� | A | B | C | D | E | F |
����ɷ� | Mg | Fe | Mg+Fe | Mg+NaCl | Fe+NaCl | Mg+Fe+NaCl |
�������� | ���������ݣ����Ե�ȼ | ______ | ���������ݣ����Ե�ȼ | �϶�����ݣ���ȼ�б����� | ������ | ���������ݣ���ȼ�б����� |
������¶� | 23.1�� | 22.8�� | 23.1�� | 24.2�� | 22.8�� | 27.2�� |
����������ۡ�
��1��ʵ��B����������Ϊ_______________��
��2��ʵ��A֤����þ����ˮ�ܷ�Ӧ����ɸ÷�Ӧ�Ļ�ѧ����ʽMg+2H2O=____+H2 ![]() ��
��
��3��ʹþ����ˮѸ�ٷ�Ӧ�����ȵ���ѷ�������þ���м���_____________��
����˼�Ľ���
��4��ͬѧ�Ƿ���ʵ�����ݷ��֣����ߵ��¶�û�дﵽʳƷ���ȴ���Ч��������ܵ�ԭ����___________��
��5��ͬѧ�Ǹ���ʵ������һ���²⣬ʵ��F�еķ�Ӧ��������ʣ�������������Ȼ�������ۣ����������۴��ڵĵ�ʵ�鷽��Ϊ��ȡ������������________��