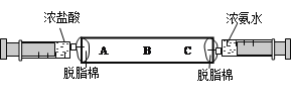��Ŀ����
����Ŀ��������ˮ����ʱ��ʹ�ú�,�ڱڻ���������һ�����ˮ������ѧ��ȤС���ˮ����ˮ���ijɷֽ�����̽��,����������в��ش����⡣
[�������]ˮ���ijɷ�����Щ?
[��������]Ӳˮ�����н϶�Ŀ�����̼�����[ Ca( HCO3)2]��̼����þ[ Mg( HCO3)2],̼����ƺ�̼����þ�ڷ��ڵ�ˮ�л�ֽ����ɲ�����ˮ��̼��ƺ�������þ������ˮ��̼��þ��������,�������γ���ˮ����
[���������]
�����:̼��ơ�̼��þ
�����:̼��ơ�������þ
�����:____________________________________________��
[���ʵ��](��ܰ��ʾ:����ˮ����û�������ɷ�,���еķ�Ӧ�����Ӧ��ȫ)
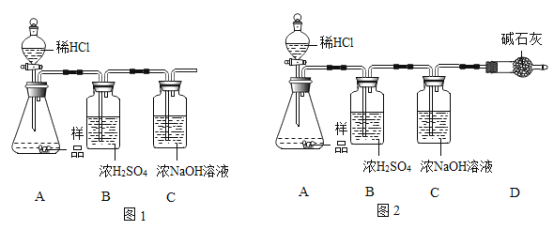
ʵ�� | ʵ����� | ʵ���������� | ʵ����� |
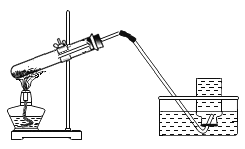
����1 | ��ͼ1��ʾ,ȡ10 gˮ����Ʒ������������ϡ�����ַ�Ӧ | ____________________����÷�Ӧ��Cװ����������4.5 g | ����ڲ���ȷ |
����2 | ��ͼ2��ʾ,ȡ10gˮ����Ʒ������������ϡ�����ַ�Ӧ | �����뷽��1��ͬ����÷�Ӧ��Cװ����������4.4 g | ����____________________��ȷ |
[��˼������]
(1)����1�ȷ���2���ݴ��ԭ����________________________________����˷���1���Ͻ���
(2)��ˮ����Ʒ�еμ�ϡ����ʱ�������кͷ�Ӧ�Ļ�ѧ����ʽΪ____________________________��
[��չ����]���������Ҫ�ɷ���ϡ����,����ϡ�����ԭ����____________________________��
���𰸡�̼��ơ�������þ��̼��þ Aװ���������ݲ��� �� �����еĶ�����̼��������Cװ�� ![]() ϡ������̼��Ʒ�Ӧ���ɵ����������ˮ���ḽ����ˮ���ı��棬��ֹ��Ӧ�������У��ﲻ������ˮ����Ŀ��
ϡ������̼��Ʒ�Ӧ���ɵ����������ˮ���ḽ����ˮ���ı��棬��ֹ��Ӧ�������У��ﲻ������ˮ����Ŀ��
��������
[���������]
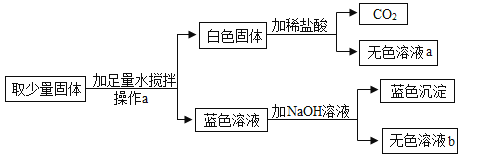
����[��������]��֪��ˮ����һ������̼���,������������þ��̼��þ�е�һ�ֻ����֣���������к���̼��ơ�������þ��̼��þ��
���̼��ơ�������þ��̼��þ��
[���ʵ��]
���ݲ����֪����Ʒ�п϶�����̼��ƣ�����Ʒ�м���������ϡ�����ַ�Ӧ���ܹ۲쵽Aװ���������ݲ���������ͼ2װ�ý���ʵ��ʱ,��÷�Ӧ��Cװ����������4.4 g,˵��10 gˮ��������ϡ���ᷴӦ����������̼������Ϊ4.4 g,���ݻ�ѧ����ʽ�ɼ����,ÿ10 g̼�����ȫ��Ӧ������4.4 g������̼��ÿ10 g̼��þ��ȫ��Ӧ������Լ5.2 g������̼���������10 g̼��ƺ�̼��þ�Ļ������ȫ��Ӧ���ɶ�����̼������һ������4.4 g,�������10g̼��ƺ�������þ�Ļ������ȫ��Ӧ���ɶ�����̼������һ��С��4.4 g,ֻ�в���۲������㷴Ӧ�����������̼������Ϊ4.4 g,��������ȷ��
���Aװ���������ݲ������ۣ�
[��˼������]
(1)ͼ1��ʾװ�õ�ĩ��û������ʢ�м�ʯ�ҵ�������ܣ�ʹ�ÿ����еĶ�����̼���Խ���Cװ���У����²�õ�����ƫ��
��������еĶ�����̼��������Cװ�ã�
(2)ϡ������������þ�����ķ�ӦΪ����кͷ�Ӧ���÷�Ӧ�Ļ�ѧ����ʽΪ![]() ��
��
���![]() ��
��
[��չ����]
ϡ������̼��Ʒ�Ӧ���ɵ����������ˮ���ḽ����ˮ���ı��棬��ֹ��Ӧ�������У��ﲻ������ˮ����Ŀ�ġ�
���ϡ������̼��Ʒ�Ӧ���ɵ����������ˮ���ḽ����ˮ���ı��棬��ֹ��Ӧ�������У��ﲻ������ˮ����Ŀ�ġ�

����Ŀ��ijУ��ѧ��ȤС�����о���������ľ����ȼ��������������Ĺ�ϵ���Ŀ����У���ȡ������ʵ�鲽�裺
��ȡ![]() ֻ
ֻ![]() ����ƿ����
����ƿ����![]() ֻ����ƿ�зֱ�װ��
ֻ����ƿ�зֱ�װ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��ˮ������ë����Ƭ��ס�����α��Ϊ
��ˮ������ë����Ƭ��ס�����α��Ϊ![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��
��
���÷ֽ��������![]() �ķ�����ȡ����������ȡ������ͨ����ˮ��������
�ķ�����ȡ����������ȡ������ͨ����ˮ��������![]() ��ƿ�е�ˮ��ȥ�����������ǵ�ľ�����β���
��ƿ�е�ˮ��ȥ�����������ǵ�ľ�����β���![]() ��ƿ�У��ѹ۲쵽����ͼ������ݣ������±���
��ƿ�У��ѹ۲쵽����ͼ������ݣ������±���
����ƿ��� |
|
|
|
|
|
����ƿ��������������� |
|
|
|
| |
������ľ����״�� | �� | �� | ���� | ��ȼ | ��ȼ |
�Իش��������⣺
![]() ����ƿ
����ƿ![]() ���������������Ϊ________�������������������������
���������������Ϊ________�������������������������![]() �ƣ�
�ƣ�
![]() ��������ʵ����ʵ������˵������ȷ����________����д��Ӧ����ĸ����
��������ʵ����ʵ������˵������ȷ����________����д��Ӧ����ĸ����
![]() ��ֻ���ڴ����в���ʹ�����ǵ�ľ����ȼ
��ֻ���ڴ����в���ʹ�����ǵ�ľ����ȼ
![]() ������ƿ���������������
������ƿ���������������![]() ʱ�������ǵ�ľ�����ܸ�ȼ
ʱ�������ǵ�ľ�����ܸ�ȼ
![]() ��ֻҪ���������ھͿ�ʹ�����ǵ�ľ����ȼ��
��ֻҪ���������ھͿ�ʹ�����ǵ�ľ����ȼ��
![]() ����ʵ�����������ȼ�յij̶���������Ũ���йأ�����Ũ��Խ��ȼ��Խ���ң������پ�һ������ʵ�����ݺ�ʵ��������д���±��У�
����ʵ�����������ȼ�յij̶���������Ũ���йأ�����Ũ��Խ��ȼ��Խ���ң������پ�һ������ʵ�����ݺ�ʵ��������д���±��У�
ʵ������ | ʵ������ | ʵ����� |
_________ | _________ | ����Ũ��Խ��ȼ��Խ���� |
����Ŀ����֪ij��ɫ��ĩ�����������ۡ�����������������������һ�ֻ��������,ij��ѧ��ȤС��Ϊȷ����ɫ��ĩ�ijɷֽ���������̽����
[��������]���������������ϡ�ᷴӦ,��ֻ�������������ܱ�����������
[�������]
ʵ����� | ʵ������ | ʵ����� |
ʵ��һ:ȡ�����ĺ�ɫ��ĩ,�ô������� | ______________�� | ��ɫ�����ĩ��һ�������������� |
ʵ���:_______________�� | �����ݲ�������Һ��ɫ�����ı� | ��ɫ����һ����������,���ܺ������������� |
[������˼]Ϊ̽����ɫ��ĩ�Ƿ�������������,С����Ϊ�ɽ�ʵ����IJ�����Ϊȡ������ɫ�����ĩ���Թ��У���������������ͭ��Һ,������_____________ʱ,��֤����ɫ�����ĩ��һ���������ۺ�������������
[����̽��]Ϊ̽����ɫ��ĩ�ɷ������ۺ�������������������,ͬѧ��������ͼʵ��;��Ӧǰ��ȡ10g��ɫ��ĩ���벣������(�����ܵ�����Ϊ50 g) ,��ͨ��һ��ʱ��һ����̼����,Ȼ���ȼ�ƾ��ơ�
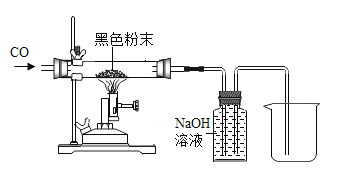
��1����Ӧǰ��ͨ��һ����̼�����ٵ�ȼ�ƾ��ƣ�Ŀ����______________��
��2����ַ�Ӧ��Ϩ��ƾ���,����ͨ��һ����̼,����ȴ�����º�ֹͣͨ�룬���������ܺ��ڹ���������Ϊ58.4g,�����ɫ��ĩ������������������������Ϊ___________________��
��3�����߿��ڵ�װ�õ�������_________________��