题目内容
 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余(反应后生成的化合物中金属都为+2价).产生H2的质量随时间变化的趋势如图.下列说法不正确的是( )
把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余(反应后生成的化合物中金属都为+2价).产生H2的质量随时间变化的趋势如图.下列说法不正确的是( )分析:等质量的甲、乙两种金属,反应后金属都没有剩余,说明酸是足量的,金属反应完全时乙用的时间少反应速度快,活动性较强,生成氢气量的不同决定了甲乙的相对原子质量的高低,利用这些知识可解决此题.
解答:解:A、反应完全时乙用的时间少,反应速度快,活动性较强,即乙的活动性比甲强,故A说法正确;
B、金属与酸反应时,一定量金属完全反应产生氢气质量=
×金属的质量,所以只有金属的质量及化合价均相同,金属的相对原子质量与反应放出氢气的多少才成反比,反应后生成的化合物中金属都为+2价,所以生成氢气多的,相对原子质量就小,所以甲的相对原子质量一定比乙小,故B说法正确;
C、生成氢气量的不同,说明消耗酸的质量不同,因为氢气来源于酸中的氢,故C说法错误;
D、放入的金属质量相等,反应后均无剩余,所以反应消耗等质量的金属,故D说法正确.
故选C.
B、金属与酸反应时,一定量金属完全反应产生氢气质量=
| 金属元素化合价 |
| 金属的相对原子质量 |
C、生成氢气量的不同,说明消耗酸的质量不同,因为氢气来源于酸中的氢,故C说法错误;
D、放入的金属质量相等,反应后均无剩余,所以反应消耗等质量的金属,故D说法正确.
故选C.
点评:此题是一道图象分析题,解题的关键是读懂图象,并能找到与图象结合的信息,属基础型常规考查题.

练习册系列答案
相关题目
 把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余.产生H2的质量随时间变化的趋势如图.下列说法正确的是( )
把某稀硫酸分为等体积的两份,放入两个烧杯中,分别加入等质量的甲、乙两种金属,反应后金属都没有剩余.产生H2的质量随时间变化的趋势如图.下列说法正确的是( )| A、甲的活动性比乙强 | B、甲的相对原子质量一定比乙小 | C、反应消耗等质量的硫酸 | D、反应消耗等质量的金属 |


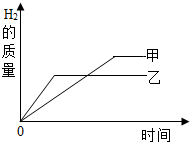
 (2012?白下区一模)把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( )
(2012?白下区一模)把某稀硫酸分为等体积的两份,分别加入等质量的甲、乙两种金属粉末(甲、乙在生成物中均为+2价),反应后金属都没有剩余,产生H2的质量随时间变化的趋势如图.下列说法正确的是( )