题目内容
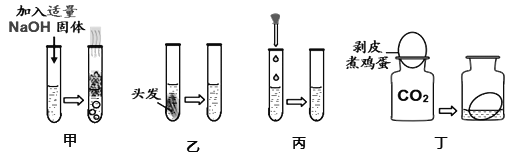
【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:
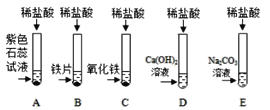
(1)试管 A 中的现象是_____,反应后试管 B 中一定有的阳离子是_____(写离 子符号);试管 C 中反应的化学方程式为_________。
(2)试管 D 中反应的微观实质是_____。该反应没有明显现象, 要证明该反应确实发生,可以预先在 Ca(OH)2 溶液中加入_________。 小芳同学把反应后 D、E 试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有 白色沉淀生成。过滤,得到白色沉淀和无色滤液。
①白色沉淀化学式为_____。
②小芳同学对 D 和 E 的反应物的用量进行描述,你认为符合上述实验现象的有_____
a.D 实验氢氧化钙溶液过量 b.D 实验稀盐酸过量
c.E 实验碳酸钠溶液过量 d.E 实验盐酸过量。
(3)选择其它类别的药品,设计实验证明小芳同学 D 和 E 反应物用量描述结果是正确的。
实验操作 | 预期实验现象 |
___________________ | _______________ |
______________ | ________________ |
【答案】 石蕊试液由紫色变红色 Fe2+ Fe2O3+6HCl═2FeCl3+3H2O 氢离子与氢氧根离子反应生成水分子 酚酞试液 CaCO3 b、c 向反应后的实验 D 溶液中滴加紫色石蕊溶液 溶液变成红色 向反应后的实验 E 溶液中滴加澄清石灰水 溶液变浑浊
【解析】(1)酸性溶液能使紫色石蕊溶液变红,所以试管 A 中的现象是溶液变为红色;反应后试管B中生成氯化亚铁,故一定有的阳离子是Fe2+;试管C中氧化铁与盐酸反应生成氯化铁和水,反应的化学方程式为6HCl+Fe2O3=2FeCl3+3H2O;(2)试管 D 中发生的是中和反应,微观实质是氢离子与氢氧根离子反应生成水分子。该反应没有明显现象, 要证明该反应确实发生,可以预先在 Ca(OH)2 溶液中加入酚酞试液,滴加盐酸时,酚酞试液由红色变为无色,证明氢氧化钙和盐酸发生了反应。碳酸钠和盐酸反应生成二氧化碳,产生气泡;碳酸钠能与氢氧化钙或氯化钙反应生成碳酸钙白色沉淀,沉淀为碳酸钙,化学式为:CaCO3。把反应后D、E试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有白色沉淀生成。说明E试管中碳酸钠一定有剩余即碳酸钠过量,D试管中反应后溶液中的溶质为氯化钙和盐酸,即盐酸过量。(3)向D实验反应后的溶液中加入紫色石蕊溶液,紫色石蕊试液变红,证明酸过量(或者加入碳酸钠,产生气泡或加入铁粉,产生气泡等);向E实验反应后的溶液中加入氯化钙(或氢氧化钙)溶液,生成白色沉淀,证明碳酸钠有剩余。

 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案