题目内容
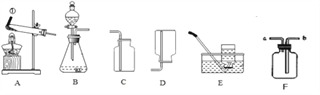
【题目】下列四个图像分别与选项中的操作相对应,其中合理的是

A. 向盐酸中滴入NaOH溶液
B. 将水通电电解一段时间
C. 加热KClO3和MnO2的混合物制取O2
D. 向FeCl3和HNO3的混合溶液中加入NaOH溶液
【答案】B
【解析】A、向盐酸中滴入NaOH溶液,溶液的pH值应该从小于7逐渐增大到7,然后大于7,故A错误;B、水在通电的条件下生成氢气和氧气,正氧负氢,体积比是1:2,故B正确;C、氯酸钾在二氧化锰的催化作用下加热生成氯化钾和氧气,固体质量逐渐减小,二氧化锰的质量分数逐渐增大,然后不变,故C错误;D、向FeCl3和HNO3的混合溶液中加入NaOH溶液,氢氧化钠会先与硝酸反应,然后再与氯化铁反应,所以沉淀质量不能从零开始,故D错误。故选B。

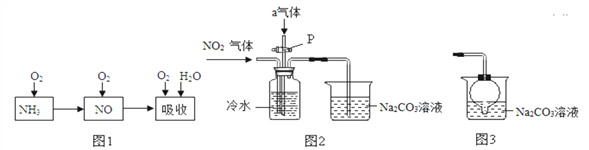
【题目】硼(B)及其化合物在工业上有许多用途。以铁硼矿(主要成分为Mg2B2O5·H2O和Fe3O4,还有少量Fe2O3、FeO、CaO、Al2O3和难溶性SiO2等)为原料制备硼酸(H3BO3)的工艺流程如图所示:

已知:①Mg2B2O5·H2O+2H2SO4![]() 2MgSO4+2H3BO3②CaSO4微溶于水
2MgSO4+2H3BO3②CaSO4微溶于水
③H2O2溶液可将Fe2+氧化为Fe3+④Fe3+、Fe2+、Al3+以氢氧化物形式开始沉淀和完全沉淀时的pH如下表:
开始沉淀 | 完全沉淀 | |
Fe3+ | 1.14 | 3.0 |
Fe2+ | 5.85 | 8.35 |
Al3+ | 3.0 | 4.7 |
请回答下列问题:
(1)利用______(填物质名称)的磁性,可将该物质直接从“铁硼矿粉”中分离。
(2)酸浸时,矿粉中的金属氧化物会和酸反应,试写出Fe2O3酸浸时的化学反应方程式__________。
(3)为了提高浸出速率(即加快反应速率),除适当增加硫酸浓度外,还可采取的措施有______(写出一条)。
(4)操作a为______,“浸渣”中含有CaSO4和______(填物质化学式)。
(5)“净化除杂”需先加H2O2溶液,然后再调节溶液的pH约为5,目的是_____。
(6)制得的粗硼酸中的主要杂质为________________(填物质化学式)。
【题目】小明、小芳二位同学为探究盐酸的化学性质,做了如下实验:
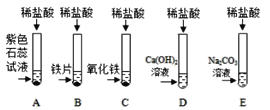
(1)试管 A 中的现象是_____,反应后试管 B 中一定有的阳离子是_____(写离 子符号);试管 C 中反应的化学方程式为_________。
(2)试管 D 中反应的微观实质是_____。该反应没有明显现象, 要证明该反应确实发生,可以预先在 Ca(OH)2 溶液中加入_________。 小芳同学把反应后 D、E 试管中的废液倒入一个洁净的烧杯中,观察到先有气泡产生,后有 白色沉淀生成。过滤,得到白色沉淀和无色滤液。
①白色沉淀化学式为_____。
②小芳同学对 D 和 E 的反应物的用量进行描述,你认为符合上述实验现象的有_____
a.D 实验氢氧化钙溶液过量 b.D 实验稀盐酸过量
c.E 实验碳酸钠溶液过量 d.E 实验盐酸过量。
(3)选择其它类别的药品,设计实验证明小芳同学 D 和 E 反应物用量描述结果是正确的。
实验操作 | 预期实验现象 |
___________________ | _______________ |
______________ | ________________ |