题目内容
【题目】已知某合金粉末除铝外,还含有铁、铜中的一种或两种。某兴趣小组在老师的指导下,对合金粉末中铁、铜的存在情况进行了探究。
(查阅资料)铝与氢氧化钠溶液反应的化学方程式为:![]() ;(产物NaAlO2易溶于水);Fe、Cu不与氢氧化钠溶液反应。
;(产物NaAlO2易溶于水);Fe、Cu不与氢氧化钠溶液反应。
(猜想)猜想1:该合金粉末中除铝外,还含有铁;
猜想2:该合金粉末中除铝外,还含有___________(填名称);
猜想3:该合金粉末中除铝外,还含有铁、铜。
(实验探究)下列实验仅供选择的试剂:10%盐酸、30%NaOH溶液。
实验方案 | 实现现象 | 结论 |
①取一定量的合金粉末,加过量的____________,充分反应后过滤,滤渣备用。 | 粉末部分溶解,并有气泡产生 | 合金中一定含有____________。 |
②取步骤①所得滤渣,加过量的__________,充分反应。 | 滤渣部分溶解,并有气泡产生,溶液呈浅绿色。 | 合金中一定含有___________ |
(探究结论)猜想3成立。
(反思)铝的金属活泼性很强,但常温下却具有很好的抗腐蚀性能,原因是______(用化学方程式表示)
【答案】铜 30%NaOH溶液 铝 10%盐酸 铁、铜 ![]()
【解析】
(1)由题干可知,猜想1认为该合金粉末中除铝外,还含有铁,猜想3认为该合金粉末中除铝外,还含有铁、铜,故猜想2可能为该合金粉末中除铝外,还含有铜,填写:铜;
(2) 铝、铁、铜中只有铝与氢氧化钠反应生成气体,故在设计实验时,先用氢氧化钠鉴别铝,填写:30%NaOH溶液;
(3)当加入30%NaOH溶液时,粉末部分溶解,并有气泡产生,故合金中有铝,填写:铝;
(4) 铁和铜的检验,用所提供的试剂中稀盐酸,故填写:10%稀盐酸;
(5)气泡产生,溶液呈浅绿色,原因是铁与稀盐酸产生氢气和氯化亚铁(浅绿色),因为铜不与稀盐酸反应,所以,滤渣部分溶解,故滤渣里一定有铁、铜,填写:铁、铜;
(6)铝的金属活泼性很强,但常温下却具有很好的抗腐蚀性能,原因是铝与氧气反应生成了一层致密的氧化物薄膜阻止了内部的铝继续被反应,故填写:![]() 。
。

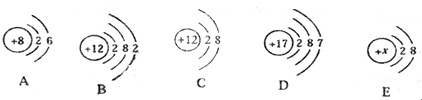
【题目】对下列实验现象的解释错误的是
A | B | C | D | |
实验现象 |
用扫描隧道显微镜获得的分子图像 |
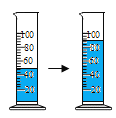
品红加入水中后,整个液体变红色 |
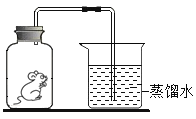
水分子在不同温度下的运动情况 |
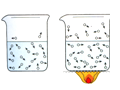
50mL水与50mL酒精混合后的体积小于100mL |
解释 | 分子的质量和体积都很小 | 分子总是不断的运动着的 | 常温时分子不运动,加热时分子才运动 | 分子有空隙 |
A.AB.BC.CD.D