题目内容
氯化铁(FeCl3)能腐蚀铜,工业以此生产镀铜线路板的流程如下.试回答:

(1)步骤②中发生了两个反应:2FeCl3+Fe=3FeCl2和 .
(2)滤渣中有 和 ,步骤③中发生反应的化学方程式是 .
(3)步骤③中,当加入稀盐酸,观察到 时,说明滤渣只剩铜.
(4)步骤②③所得滤液中的FeCl2可与一种双原子分子的单质发生化合反应生成FeCl3,实现循环使用.该单质的化学式为 .

(1)步骤②中发生了两个反应:2FeCl3+Fe=3FeCl2和
(2)滤渣中有
(3)步骤③中,当加入稀盐酸,观察到
(4)步骤②③所得滤液中的FeCl2可与一种双原子分子的单质发生化合反应生成FeCl3,实现循环使用.该单质的化学式为
考点:物质的相互转化和制备,金属的化学性质,书写化学方程式、文字表达式、电离方程式
专题:物质的制备
分析:由流程图可知废液的处理过程为:利用过量的饱和氯化铁溶液与镀铜电路板上金属铜反应,然后用过量铁粉把生成的氯化铜置换得到金属铜,同时把过量的氯化铁溶液转变为氯化亚铁溶液,最后,进行过滤分离出金属铜而回收铜,并把滤液氯化亚铁再转化为氯化铁溶液循环利用.据此分析完成相关的问题.
解答:解:(1)过量的铁粉与氯化铜发生置换反应,得到金属铜和氯化亚铁;同时,铁粉与剩余的氯化铁溶液反应,把混合溶液全部转化为纯净的氯化亚铁溶液;故反应的方程式为:Fe+CuCl2═FeCl2+Cu;
(2)由于加入过量的铁粉,所以滤渣中不但有置换出来的铜,还有未反应完的铁;
步骤③加入稀盐酸与滤渣中的铁粉反应而除去多余的铁,反应生成氯化亚铁和氢气;故反应的方程式为:2HCl+Fe═FeCl2+H2↑;
(3)由于铁能够和稀盐酸反应产生气泡,因此观察到无气泡说明只含有铜,而没有铁;
(4)根据质量守恒定律,化学反应前后元素的种类不变,因此FeCl2可与一种双原子分子的单质发生化合反应生成FeCl3,该单质应该是氯气;
得到的纯净氯化亚铁溶液经过处理后可形成氯化铁溶液,再用来处理镀铜的电路板,循环利用;过程中把镀铜电路板上的铜回收再利用;
故答:FeCl3、Cu或FeCl2、Cu.故答案为:(1)Fe+CuCl2=FeCl2+Cu;
(2)Fe 和 Cu; Fe+2HCl=FeCl2+H2↑;
(3)无气泡;(4)Cl2.
(2)由于加入过量的铁粉,所以滤渣中不但有置换出来的铜,还有未反应完的铁;
步骤③加入稀盐酸与滤渣中的铁粉反应而除去多余的铁,反应生成氯化亚铁和氢气;故反应的方程式为:2HCl+Fe═FeCl2+H2↑;
(3)由于铁能够和稀盐酸反应产生气泡,因此观察到无气泡说明只含有铜,而没有铁;
(4)根据质量守恒定律,化学反应前后元素的种类不变,因此FeCl2可与一种双原子分子的单质发生化合反应生成FeCl3,该单质应该是氯气;
得到的纯净氯化亚铁溶液经过处理后可形成氯化铁溶液,再用来处理镀铜的电路板,循环利用;过程中把镀铜电路板上的铜回收再利用;
故答:FeCl3、Cu或FeCl2、Cu.故答案为:(1)Fe+CuCl2=FeCl2+Cu;
(2)Fe 和 Cu; Fe+2HCl=FeCl2+H2↑;
(3)无气泡;(4)Cl2.
点评:本题考查了工业生产印刷线路板,从废液中回收铜并得到FeCl3溶液循环利用的原理分析和反应判断,熟练利用金属活动性顺序,提纯和回收利用金属;会处理实验流程图是解题的关键.

练习册系列答案
相关题目
下列物质放入水中,能形成溶液的是( )
| A、大理石 | B、汽油 |
| C、氢氧化钠 | D、面粉 |
 (1)合理搭配饮食是我们健康生活的理念.比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、水、蛋白质、淀粉、无机盐和
(1)合理搭配饮食是我们健康生活的理念.比如早餐搭配:牛奶、面包、黄油、水果等,其中含有的营养素有油脂、水、蛋白质、淀粉、无机盐和
 同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.
同学们发现NaOH溶液与NaHCO3溶液混合后无明显现象,产生疑问:两种物质是否发生了化学反应?在老师的帮助下,他们通过以下探究过程证明NaHCO3溶液与NaOH溶液发生了反应.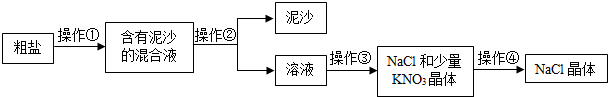
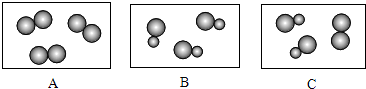 如图(大小圆圈分别表示一种元素的原子)表示气体分子示意模型,其中属于化合物的是
如图(大小圆圈分别表示一种元素的原子)表示气体分子示意模型,其中属于化合物的是