题目内容
下面是实验室常用的一些实验装置,请回答下列问题:
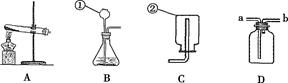
(1)写出带标号仪器的名称:①_________ ;②__________;
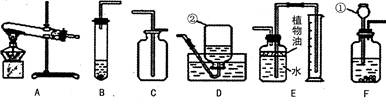
(2)在实验室用高锰酸钾制取氧气,应选用的制取装置是_______(填序号.下同),反应的化学方程式是___________________.
(3)若选用B、C组合在实验室可制取CO:气体,反应方程式为________________________.
(4)E装置可用来测量生成C02气体的体积,其中在水面上放一层植物油的目的是________________________
(5)为探究二氧化碳的性质,进行如下实验。
①将二氧化碳通入水中,用pH试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法:_________________。
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象,欲用化学方法证明C02和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、稀硫酸三种试剂中选用一种试剂进行实验,简述证明的理由:_____________________________________。
③将少量C02气体通入盛有大量澄清Ca (OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会_________(填写下列各项序号).
A.增大 B.减少 c.不变 D.无法判断
(6)取12g石灰石(主要成分是CaC03,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应。反应结束后,称量烧杯中剩余物质的总质量为107. 6g(不包括烧杯的质量,且气体溶解忽略不计)。则稀盐酸中溶质的质量分数是多少?

(1)写出带标号仪器的名称:①_________ ;②__________;
(2)在实验室用高锰酸钾制取氧气,应选用的制取装置是_______(填序号.下同),反应的化学方程式是___________________.
(3)若选用B、C组合在实验室可制取CO:气体,反应方程式为________________________.
(4)E装置可用来测量生成C02气体的体积,其中在水面上放一层植物油的目的是________________________
(5)为探究二氧化碳的性质,进行如下实验。
①将二氧化碳通入水中,用pH试纸粗略测定二氧化碳水溶液的酸碱性强弱,请简述测定的方法:_________________。
②将二氧化碳通入氢氧化钠溶液中,并无明显反应现象,欲用化学方法证明C02和NaOH溶液确实发生了化学反应,请从NaCl溶液、CaCl2溶液、稀硫酸三种试剂中选用一种试剂进行实验,简述证明的理由:_____________________________________。
③将少量C02气体通入盛有大量澄清Ca (OH)2溶液的大烧杯中,烧杯中溶液的质量与之前相比会_________(填写下列各项序号).
A.增大 B.减少 c.不变 D.无法判断
(6)取12g石灰石(主要成分是CaC03,杂质不参加反应)放入烧杯中,向其中加入100g一定质量分数的稀盐酸,二者恰好完全反应。反应结束后,称量烧杯中剩余物质的总质量为107. 6g(不包括烧杯的质量,且气体溶解忽略不计)。则稀盐酸中溶质的质量分数是多少?
(1)长颈漏斗 集气瓶
(2)AC (或AD) 2KMn04 ="==" K2Mn04+Mn02+02↑
(3) CaCO3 + 2HCl ="=" CaCl2 + H2O + CO2↑
(4)植物油可避免CO2与水接触部分溶解,导致测量误差
(5)①用玻璃棒蘸取溶液滴到pH试纸上,变色后跟标准比色卡对照,读出数值。
②取少量反应后的溶液,滴入CaCl2溶液,产生白色沉淀,证明CO2和NaOH溶液确实发生了化学反应 ③B
(6)(3分)7.3%
(2)AC (或AD) 2KMn04 ="==" K2Mn04+Mn02+02↑
(3) CaCO3 + 2HCl ="=" CaCl2 + H2O + CO2↑
(4)植物油可避免CO2与水接触部分溶解,导致测量误差
(5)①用玻璃棒蘸取溶液滴到pH试纸上,变色后跟标准比色卡对照,读出数值。
②取少量反应后的溶液,滴入CaCl2溶液,产生白色沉淀,证明CO2和NaOH溶液确实发生了化学反应 ③B
(6)(3分)7.3%
(1)①长颈漏斗,②集气瓶(2)在实验室用高锰酸钾制取氧气,由于是固体在受热条件下制取,所以制取装置是A,根据氧气的密度比空气大,和不溶于水解析解答(3)实验室用碳酸钙和盐酸反应生成二氧化碳和水,氯化钙,(4)E装置可用来测量生成CO2气体的体积,其中在水面上放一层植物油的目的是:植物油可避免CO2与水接触部分溶解,导致测量误差,(5)①用pH试纸来测定二氧化碳的水溶液时,可以用玻璃棒蘸取溶液滴到pH试纸上,然后跟标准比色卡对照,读出数值即可;
②二氧化碳和氢氧化钠反应生成了碳酸钠,而碳酸钠可以和氯化钙反应生成碳酸钙沉淀,故可以用氯化钙溶液来证明;
③将二氧化碳通入澄清石灰水中,二氧化碳和氢氧化钙反应生成了碳酸钙沉淀,而使溶液中的溶质减少,故溶液的质量要减少,所以B选项是正确的
(6)根据化学方程式可求得参加反应的氯化氢的质量;
解:生成二氧化碳的质量为:12g+100g – 107.6g =" 4.4g"
设稀盐酸中氯化氢的质量为 x,
CaCO3+2HCl=CaCl+H2O+CO2↑
73 44
X 4.4g
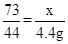 x=7.3g
x=7.3g
稀盐酸中溶质的质量分数:
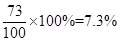
答:稀盐酸中溶质的质量分数为7.3%。
②二氧化碳和氢氧化钠反应生成了碳酸钠,而碳酸钠可以和氯化钙反应生成碳酸钙沉淀,故可以用氯化钙溶液来证明;
③将二氧化碳通入澄清石灰水中,二氧化碳和氢氧化钙反应生成了碳酸钙沉淀,而使溶液中的溶质减少,故溶液的质量要减少,所以B选项是正确的
(6)根据化学方程式可求得参加反应的氯化氢的质量;
解:生成二氧化碳的质量为:12g+100g – 107.6g =" 4.4g"
设稀盐酸中氯化氢的质量为 x,
CaCO3+2HCl=CaCl+H2O+CO2↑
73 44
X 4.4g
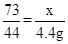 x=7.3g
x=7.3g稀盐酸中溶质的质量分数:
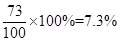
答:稀盐酸中溶质的质量分数为7.3%。

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案
相关题目