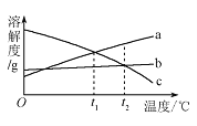
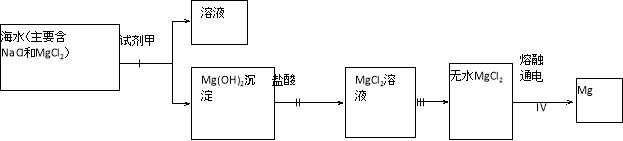
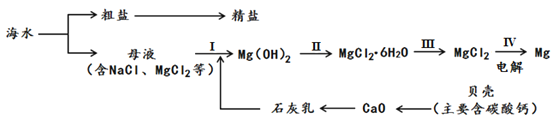
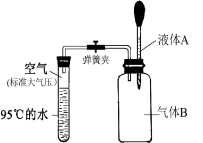
题目内容
【题目】(7分)纯碱样品中含有少量的氯化钠,某同学为测定纯碱样品中碳酸钠的含量,他取该纯碱样品12g,全部溶解在100g水中,再加入氯化钙溶液,所加氯化钙的质量如图所示。

请计算:
(1)纯碱样品中碳酸钠的质量。
(2)所加氯化钙溶液的溶质质量分数。
(计算结果保留到0.1%,下同)
(3)恰好完全反应后所得溶液中溶质的质量分数。
【答案】(1)10.6g;(2)13.8%;(3)7.2%
【解析】
试题分析:向氯化钠和碳酸钠的混合溶液中加入氯化钙溶液,碳酸钠和氯化钙发生反应生成碳酸钙沉淀;(1)利用碳酸钠与氯化钙反应的化学方程式,根据碳酸钙的质量求出碳酸钠的质量;(2)利用碳酸钠与氯化钙反应的化学方程式,根据碳酸钙的质量求出氯化钙的质量,求出氯化钙溶液的溶质质量分数;(3)反应后所得滤液中溶质的质量分数=![]() ×100%,溶质是氯化钠,包括原混合物中的氯化钠(用纯碱样品的质量-碳酸钠的质量)和反应生成的氯化钠(根据碳酸钙的质量算出),滤液的质量可用纯碱样品的质量+水的质量+氯化钙溶液的质量-沉淀的质量求出。
×100%,溶质是氯化钠,包括原混合物中的氯化钠(用纯碱样品的质量-碳酸钠的质量)和反应生成的氯化钠(根据碳酸钙的质量算出),滤液的质量可用纯碱样品的质量+水的质量+氯化钙溶液的质量-沉淀的质量求出。
解:设纯碱样品中Na2CO3的质量为X,恰好完全反应时所需CaCl2的质量为Y,生成NaCl的质量为Z。
Na2CO3 + CaCl2 = CaCO3↓+ 2NaCl (1分)
106 111 100 117
X Y 10g Z
106:100 = X:10g111:100 =Y:10g 10O:117 = 10g:Z
解得X=10.6g Y=11.1g Z=11.7g (3分)
(2) CaCl2溶液的溶质质量分数为: 11.1g/80.4g×100%=13.8% (1分)
(3)溶液的质量=12g+100g+80.4g-10g=182.4g
溶质的质量=11.7g+(12g-10.6g)=13.1g
溶质质量分数=溶质的质量/溶液的质量×100%=13.1g/182.4g×100%=7.2% (2分)
答:纯碱样品中Na2CO3的质量为10.6g,所加.CaCl2溶液的溶质质量分数为13.8%,恰好完全反应后所得溶液中溶质的质量分数为7.2%。

 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案